В недавнем обзоре, опубликованном в журнале Thrombosis Research , исследователи сообщили о механизмах, вовлеченных в коагулопатию при коронавирусной болезни 2019 (COVID-19), и о значении тяжелого острого респираторного синдрома, вызванного коронавирусом 2 (SARS-CoV-2), для больных раком в отношении исходов, тромбоэмболических осложнений. риски и последствия стратегий управления.
Исследования показали, что больные раком подвержены повышенному риску тяжести течения COVID-19 и связанных с ним неблагоприятных исходов либо из-за самого новообразования (например, рака легких и гематологических злокачественных новообразований с гиперкоагуляцией), либо из-за иммунологической супрессии в результате противоопухолевой терапии. . Тяжелые инфекции SARS-CoV-2 могут осложняться коагулопатиями, такими как COVID-19, что может привести к венозной тромбоэмболии.
Об обзоре
В настоящем обзоре исследователи описали пути коагулопатии COVID-19 и их значимость у онкологических больных в отношении венозных тромбоэмболических осложнений.
Механизмы коагулопатии COVID-19
Тяжелая форма COVID-19 привела к значительной заболеваемости, включая полиорганную дисфункцию и дыхательную недостаточность, а также к летальному исходу. Возраст, ожирение и сопутствующие заболевания, такие как гипертония, легочные заболевания и диабет, являются установленными факторами риска тяжести COVID-19. Кроме того, люди с ослабленным иммунитетом, такие как лица, перенесшие трансплантацию органов, принимающие иммунодепрессанты и лица с гематологическими злокачественными новообразованиями, получающие противоопухолевые препараты, очень склонны к тяжелым инфекциям SARS-CoV-2.
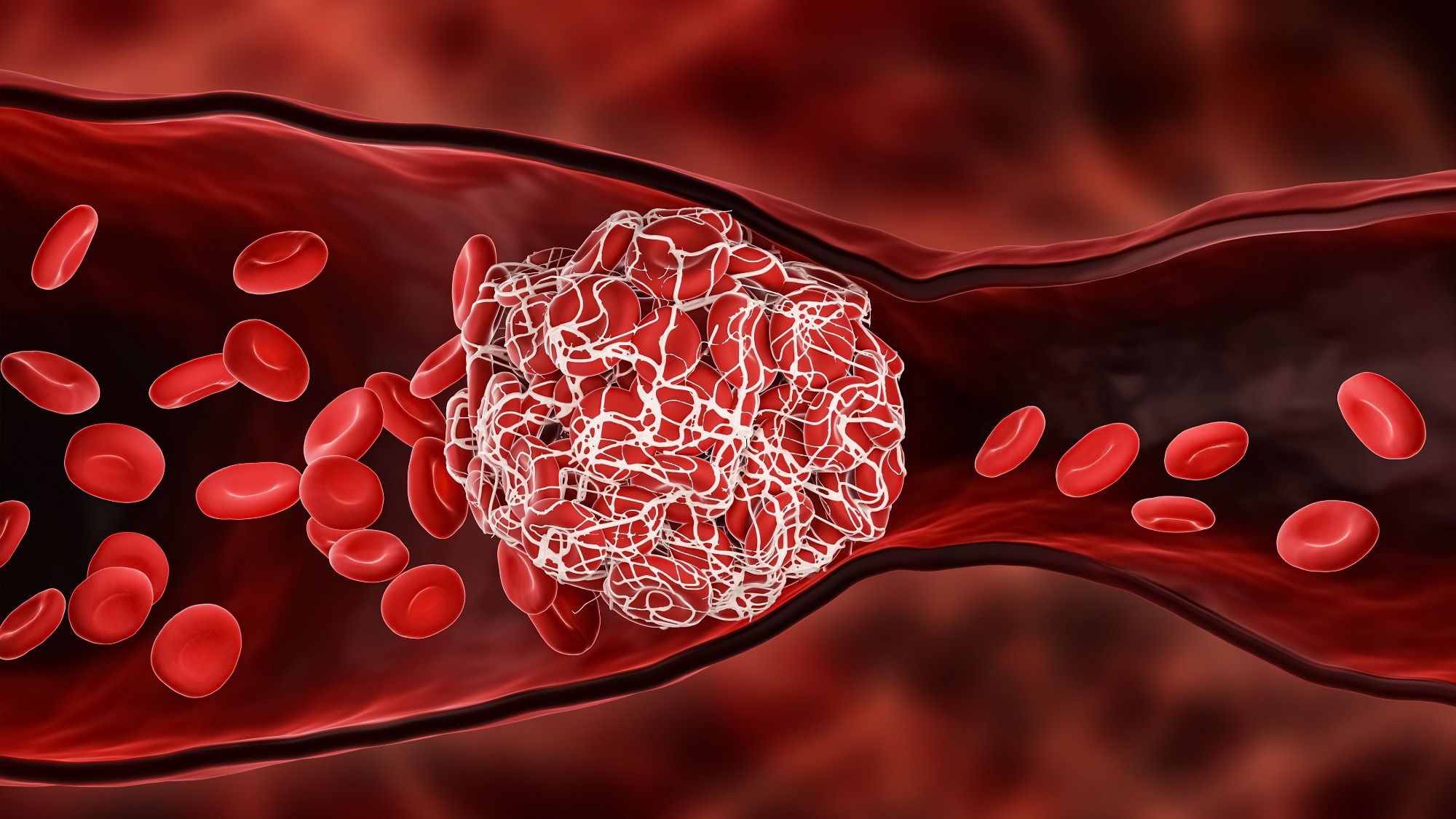
У пациентов с тяжелым течением COVID-19 развиваются нарушения гемостаза, такие как венозная тромбоэмболия, риск которой среди онкологических больных в 12 раз выше, чем у здоровых людей. Коагулопатия, связанная с SARS-CoV-2, связана со значительно повышенным уровнем D-димера с более глубоким повышением, чем у онкологических больных. Кроме того, серологические уровни фибриногена, фактора VIII и активаторов плазминогена тканевого типа (t-PA) повышены в ответ на цитокиновый шторм [особенно интерлейкин (IL)-6] при COVID-19, с аномальной коагуляцией и повышенным вязкоупругость тканей.
Повышенные уровни плазмина могут активировать молекулы металлопротеиназы в модификации внеклеточного матрикса, необходимого для утечки из капилляров и отека легких. Количество тромбоцитов и ингибиторов свертывания крови, таких как протеин С и антитромбин, снижается при тяжелом течении COVID-19. Кроме того, инфекции SARS-CoV-2 связаны с образованием нейтрофильных внеклеточных ловушек (NET) (NETosis) в кровеносных сосудах, индуцированных активацией комплемента и IL-8.
НЭО способствуют образованию тромба путем активации внутреннего пути свертывания и обеспечивают платформу для эритроцитов, тромбоцитов и прокоагулянтов, таких как vWF (фактор фон Виллебранда). Следовательно, маркеры НЕТоза, такие как цитруллинированный гистон H3 и комплекс миелопероксидаза (МПО)-дезоксирибонуклеиновая кислота (ДНК), повышены при тяжелых инфекциях SARS-CoV-2. NET-образующие нейтрофилы совместно заселяют тромбоциты в легочных микротромбах пациентов с COVID-19, а NET были обнаружены в изобилии в тромбах коронарных сосудов у пациентов с инфарктом миокарда (ИМ), связанным с COVID-19.
Возмущения в эндотелиальных клетках после высвобождения vWF обеспечивают идеальную поверхность для внутрисосудистого образования тромбов при инфекциях SARS-CoV-2. Расщепляющая способность ADAMTS13 (дезинтегрин и металлопротеиназа с мотивом тромбоспондина типа 1, член 13) может быть нарушена, что приводит к тромботическим микроангиопатиям в сосудах многих органов при COVID-19. Инфекционная коагулопатия SARS-CoV-2, сопровождающаяся утолщением сосудистой стенки, стенозом и образованием микротромбов, приводит к гиперкоагуляционной ситуации, повышая риск тромбоэмболических осложнений, потенцируемых внутренними линиями и иммобилизацией среди госпитализированных SARS-CoV-2-позитивных пациентов.
Актуальность коагулопатии, связанной с SARS-CoV-2, при раке
Сообщается, что у онкологических больных с низким уровнем лимфоцитов, особенно у тех, кто недавно перенес серьезные операции или химиотерапию, риск смерти, связанный с COVID-19, в два и в 1,2 раза выше среди гематологических злокачественных новообразований и других онкологических больных. Исследования показали, что коагуляционная и воспалительная реакции на COVID-19 у больных раком выше, чем у пациентов без рака.
Документально подтверждено, что у пациентов с легкой и тяжелой формами COVID-19 в шесть и в три раза выше риск развития легочной эмболии и венозного тромбоза соответственно, наиболее значимым фактором риска для которых было наличие активных новообразований. Сообщалось, что частота венозных тромбоэмболий выше (10%) среди пациентов, недавно получавших противоопухолевую терапию, по сравнению с теми, кто этого не делал (6%).
Растущее количество данных свидетельствует о том, что профилактика тромбоза высокими дозами имеет лишь незначительно меньшую безопасность и большую эффективность по сравнению с традиционной дозированной профилактикой среди госпитализированных больных раком, инфицированных SARS-CoV-2; тем не менее, клинические исследования не подтверждают высокую дозу антитромботической профилактики среди тяжелобольных пациентов с COVID-19 из-за высокого риска кровотечения. Открытие может быть распространено на пациентов со злокачественными новообразованиями, которые также имеют повышенный риск кровотечения.
Антитромботическая профилактика не рекомендуется не госпитализированным пациентам со злокачественными новообразованиями, инфицированными SARS-CoV-2; тем не менее, соотношение риска и пользы может смещаться в сторону стандартной дозы профилактики тромбоза для амбулаторных пациентов во время активной инфекции SARS-CoV-2, но это необходимо подтвердить в дальнейших клинических исследованиях. У пациентов с гематологическими злокачественными новообразованиями уровень сероконверсии значительно ниже с низкими титрами антител против SARS-CoV-2, чем у здоровых людей. Вакцины против COVID-19 считаются безопасными для больных раком, хотя есть опасения по поводу проникновения и удержания матричной рибонуклеиновой кислоты (мРНК) в опухолевых клетках для вакцинации мРНК.
В целом результаты обзора показали, что COVID-19 может повышать риск венозного тромбоза у пациентов с активным раком, особенно у тех, кто принимает иммуномодуляторы. Поэтому необходимы стратегии для оптимизированной защиты больных раком от COVID-19. Стратегии ведения для улучшения исходов COVID-19 у пациентов со злокачественными опухолями (такие как профилактика высокими дозами антитромботических препаратов) отсутствуют и требуют дальнейшего изучения с акцентом на безопасность и эффективность.




















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.