В недавнем исследовании, опубликованном в журнале Science Translational Medicine , исследователи из США разработали двухвалентную вакцину против коронавирусной болезни 2019 (COVID-19) на платформе информационной рибонуклеиновой кислоты (мРНК).
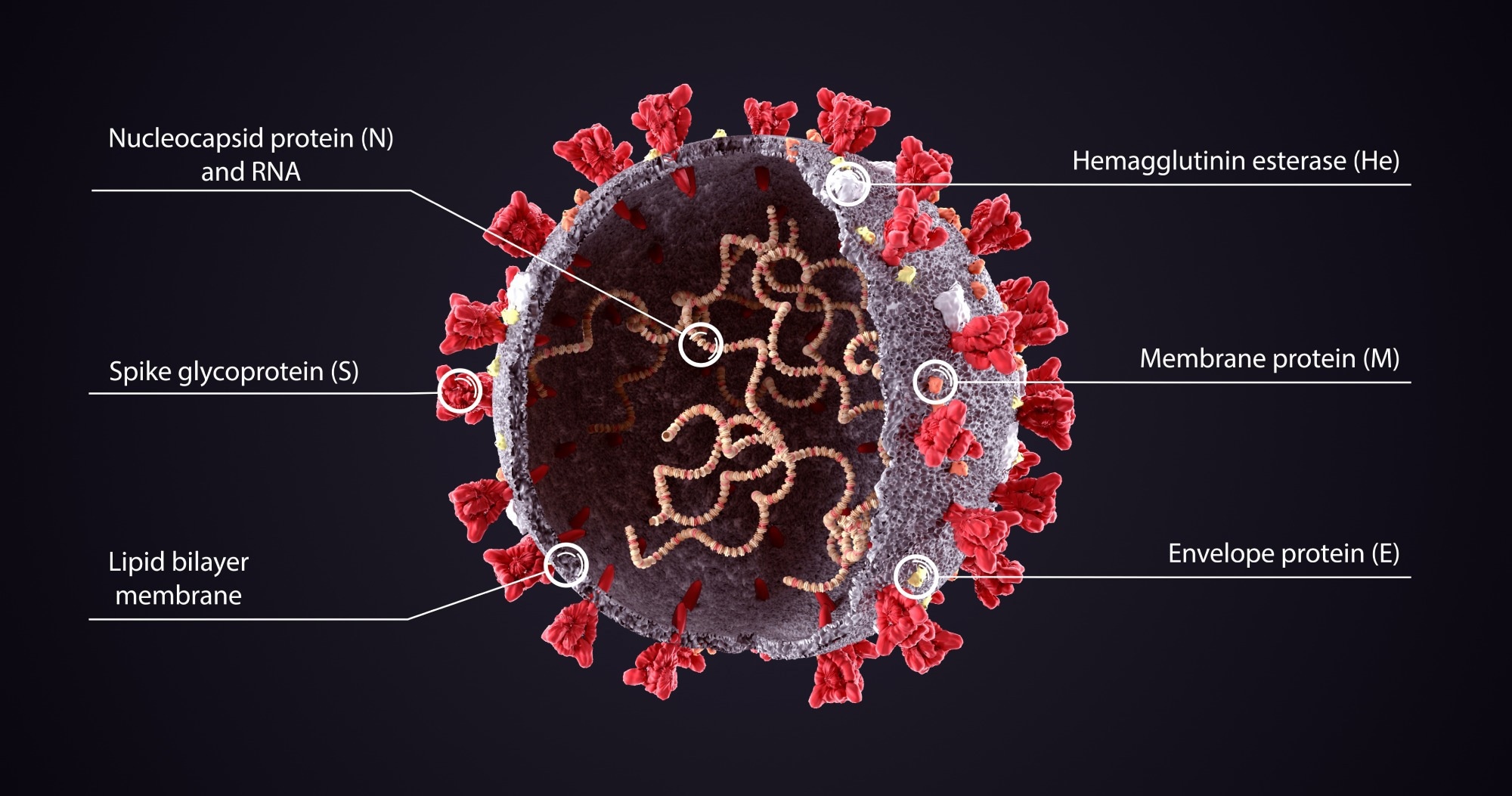
Эта вакцина на основе мРНК-липидных наночастиц (LNP) кодирует полноразмерный нуклеокапсидный (N) белок предкового штамма коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) Wuhan-Hu1. Они оценили его иммуногенность и эффективность на моделях мышей и хомяков против всех вызывающих озабоченность вариантов SARS-CoV-2 (ЛОС) отдельно и в сочетании с текущими клинически используемыми вакцинами на основе мРНК на основе шиповидного (S) белка.
Исследование: Двойная вакцинация мРНК шипа и нуклеокапсида обеспечивает защиту от вариантов SARS-CoV-2 Omicron и Delta в доклинических моделях . Кредит изображения: Орфей FX / Shutterstock
Фон
Все вакцины против COVID-19, предназначенные для борьбы с инфекциями SARS-CoV-2, нацелены на S-белок SARS-CoV-2 или его рецептор-связывающий домен (RBD) для индукции реакции мощного нейтрализующего антитела (nAb). Таким образом, исследователи предположили, что вакцина, нацеленная на более консервативный белок SARS-CoV-2, или мультивалентные вакцины обеспечат более широкую защиту от вновь появляющихся сильно мутированных вариантов SARS-CoV-2. Белок N SARS-CoV-2 представляет собой высококонсервативный и мощный иммуноген, который, как показано, вызывает сильный Т-клеточный ответ, что делает его идеальным кандидатом для включения в вакцины следующего поколения.
Об исследовании
В настоящем исследовании исследователи оценили иммуногенность состава вакцины мРНК-N у мышей BALB/c. Они создали две группы, по семь мышей в каждой, и вакцинировали их фосфатно-солевым буфером (PBS) (имитация) или 1 мкг м-РНК N-вакцины внутримышечно (IM) на нулевой неделе (основная) и неделе 3 (бустерная). После первичной вакцинации команда собрала образцы сыворотки для анализа на антитела. После ревакцинации мышей усыпили для дальнейших иммунологических анализов.

Solgar, пиколинат цинка, 100 таблеток
Команда исследовала ответы Т-клеток в спленоцитах с помощью проточной цитометрии. Точно так же они измерили N-специфический Т-клеточный ответ с помощью внутриклеточного цитокинового окрашивания (ICS) спленоцитов. Кроме того, они провели иммуноферментный точечный анализ интерферона-гамма (IFN-γ) (ELISPOT) для оценки Т-клеточных ответов, индуцированных вакциной мРНК-N.
Кроме того, исследователи использовали твердофазный иммуноферментный анализ (ELISA) для определения титра антител N-специфического связывающего иммуноглобулина G (IgG). Команда провела аналогичные оценки вакцин против SARS-CoV-2 Delta VOC у сирийских хомяков.
Результаты исследования
мРНК-N была высокоиммуногенной, но лишь умеренно контролировала инфекцию SARS-CoV-2. Однако комбинированная вакцинация мРНК-S+N более надежно контролировала ЛОС SARS-CoV-2 Delta и Omicron в легких инфицированных мышей, чем только мРНК-S, и обеспечивала дополнительную защиту от обоих вариантов, что приводило к снижению вирусной нагрузки в их верхних дыхательных путях. тракта (УРТ).
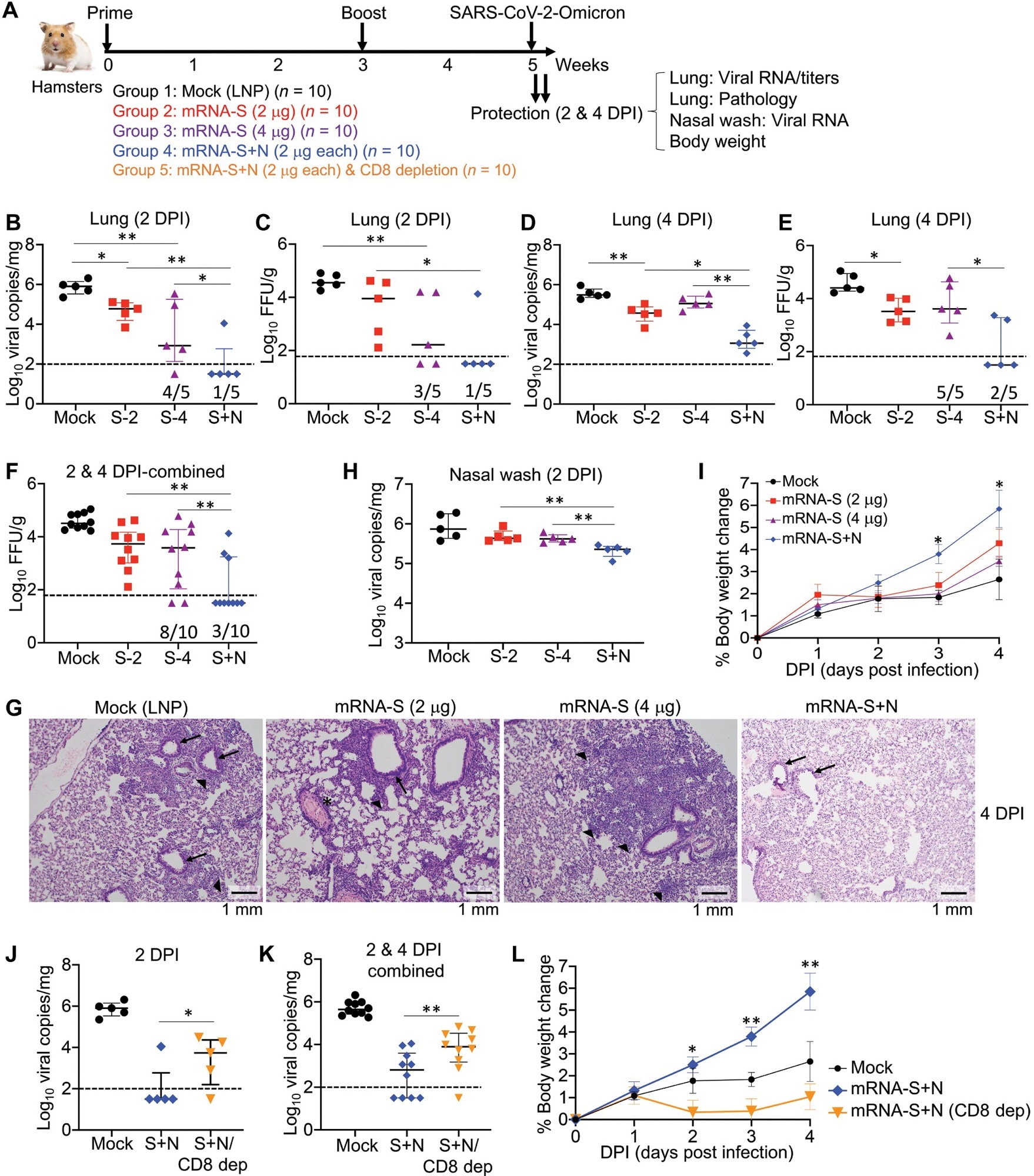
Исследование предоставило значительные доказательства, свидетельствующие об участии Т-клеток в индуцированной вакциной мРНК-S+N защите от вариантов SARS-CoV-2. Например, мРНК-N сама по себе индуцировала умеренную защиту как от штаммов SARS-CoV-2, так и от штаммов Delta в отсутствие нейтрализующих антител. Аналогичным образом, результаты анализа истощения клеток in vivo предполагают потенциальное участие кластера Т-клеток дифференцировки 8 (CD8+) в иммунной защите, индуцированной вакциной мРНК-S+N. Авторы провели антиген-специфический иммунный анализ и обнаружили, что индукция N-специфического иммунитета с усилением S-специфического иммунитета помогла бивалентной мРНК-вакцине вызвать более сильный иммунный ответ.
Интересно, что вакцина на основе мРНК S и комбинированная вакцина (мРНК-S+N) имели сходные дозы мРНК-S, но усиливали S-специфический иммунитет. Одна из гипотез состоит в том, что после вакцинации вакциной мРНК-S+N между N- и S-антигенами возникали эффекты перекрестного праймирования. Также вероятно, что коиммунизация мРНК-N индуцировала иммунную среду, которая способствовала развитию S-специфического иммунитета. Тем не менее, будущие исследования должны изучить все события после комбинированной вакцинации мРНК-S+N, включая презентацию антигена и стимуляцию врожденных и воспалительных реакций.
Выводы
В исследовании подчеркивается, что, поскольку платформа мРНК-ЛНП была протестирована и показала благоприятный профиль безопасности в многочисленных клинических исследованиях на людях, этот подход можно быстро сделать клинически жизнеспособным против еще не появившихся летучих органических соединений SARS-CoV-2. Предыдущие исследования продемонстрировали проблемы при разработке вакцин против COVID-19 с последовательностями, специфичными для летучих органических соединений. Вакцина, протестированная в текущем исследовании, имела аминокислотные последовательности мРНК-N и мРНК-S из Wuhan-Hu-1. Тем не менее, он обеспечил надежную защиту как от летучих органических соединений Delta, так и от Omicron, что является образцовым. Дальнейшее тестирование комбинированной вакцины на приматах, отличных от человека (NHP), предоставит больше возможностей для оценки ее безопасности и эффективности.
У хомяков, зараженных летучими органическими соединениями SARS-CoV-2, комбинированная вакцина мРНК-S+N индуцировала устойчивый вирусный контроль в легких. Однако его аддитивный противовирусный эффект, по-видимому, уменьшался при ВДП. Поэтому в будущих исследованиях следует изучить подходы к гетерологичной вакцинации, включающие различные вакцинные платформы и способы иммунизации. Например, стратегии вакцинации с использованием в/м, интраназального и перорального введения для улучшения защиты от ЛОС в ВДП.























Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.