В недавнем исследовании, опубликованном в журнале PNAS , исследователи из Финляндии и США сообщили о новом пептиде с гептадным повтором 2 (HR2), который ингибирует коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2) без каких-либо химических модификаций.
Исследование: наномолярное ингибирование инфекции SARS-CoV-2 немодифицированным пептидом, нацеленным на промежуточное соединение прешпильки шиповидного белка . Изображение предоставлено: Катерина Кон / Shutterstock
Фон
SARS-CoV-2 постоянно развивается со всеми его вариантами проблем (VOC), содержащими мутации в рецептор-связывающем домене (RBD) его шиповидного (S) гликопротеина , производящего все вакцины против коронавирусной болезни 2019 (COVID-19) и моноклональные антитела ( mAb) терапия неэффективна.
Существует острая необходимость в более эффективных противовирусных препаратах против SARS-CoV-2, особенно тех, которые нацелены на структуры и менее подвержены мутациям (например, гептадные повторы 1 и 2 (HR1-HR2), шестиспиральный пучок SARS-CoV-2). С).
Ранее исследователи использовали несколько подходов к структурной инженерии для создания более эффективных ингибиторов на основе HR2 на основе 36 аминокислотных сегментов S-остатков SARS-CoV-2 1168–1203.
Об исследовании
В настоящем исследовании исследователи обнаружили, что немодифицированный пептид HR2 SARS-CoV-2, охватывающий остатки S 1162–1203, названный longHR2_42, обладал значительно улучшенными свойствами ингибирования SARS-CoV-2 по сравнению со всеми предыдущими попытками. Они охарактеризовали пучок HR1-HR2, используя метод молекулярного каркаса, чтобы определить его структуру криоэлектронной микроскопии высокого разрешения (крио-ЭМ) длинного HR2_45, связанного с HR1.
Затем они разработали расширенный пептид HR2 с более длинной N-концевой областью, охватывающей аминокислотные остатки 1159–1179, с использованием Coot, который достиг ингибирования SARS-CoV-2 в наномолярном (нМ) диапазоне. Они усовершенствовали структуру в Rosetta, используя протокол автоматического уточнения структуры. Аналогичным образом они оценили образование комплекса HR1-HR2, используя собственную флуоресценцию при электрофорезе в прозрачном нативном полиакриламидном геле (CN-PAGE).

Solgar, пиколинат цинка, 100 таблеток
Исследователи разработали два анализа для обнаружения комплексообразования между вариантами HR2 и HR1 и анализ слияния клеток для проверки влияния N-концевого удлинения HR2 на ингибирование функции слияния мембран SARS-CoV-2 S.
В первом анализе использовалась клеточная поверхность Escherichia coli для отображения пептидов HR2 на усиленном каркасе белка OmpX с круговой пермутацией (eCPX). Затем исследователи инкубировали эти клетки с меченым зеленым флуоресцентным белком (GFP) HR1 и GFP-положительными клетками, экспрессирующими пептиды HR2, связывающие HR1, которые они отобрали с помощью сортировки флуоресцентно-активированных клеток (FAC). Во втором анализе использовали дисплей информационной рибонуклеиновой кислоты (мРНК) для обнаружения образования комплекса HR2-HR1.
Результаты исследования
Новый удлиненный N-концевой пептид HR2, разработанный в текущем исследовании, продемонстрировал примерно в 100 раз более сильное ингибирование всех основных вариантов SARS-CoV-2 с полумаксимальной ингибирующей концентрацией (IC 50 ), равной ~1 нМ, по оценке клеточный анализ слияния. Примечательно, что он имел примерно в 10 раз более низкую ингибирующую активность в отношении варианта Омикрон. Три мутации в области HR1 Omicron — Q954H, N969K и L981F — все вложены в область между HR1 и N-концевым удлинением HR2, что объясняет более слабую ингибирующую активность longHR2_42.
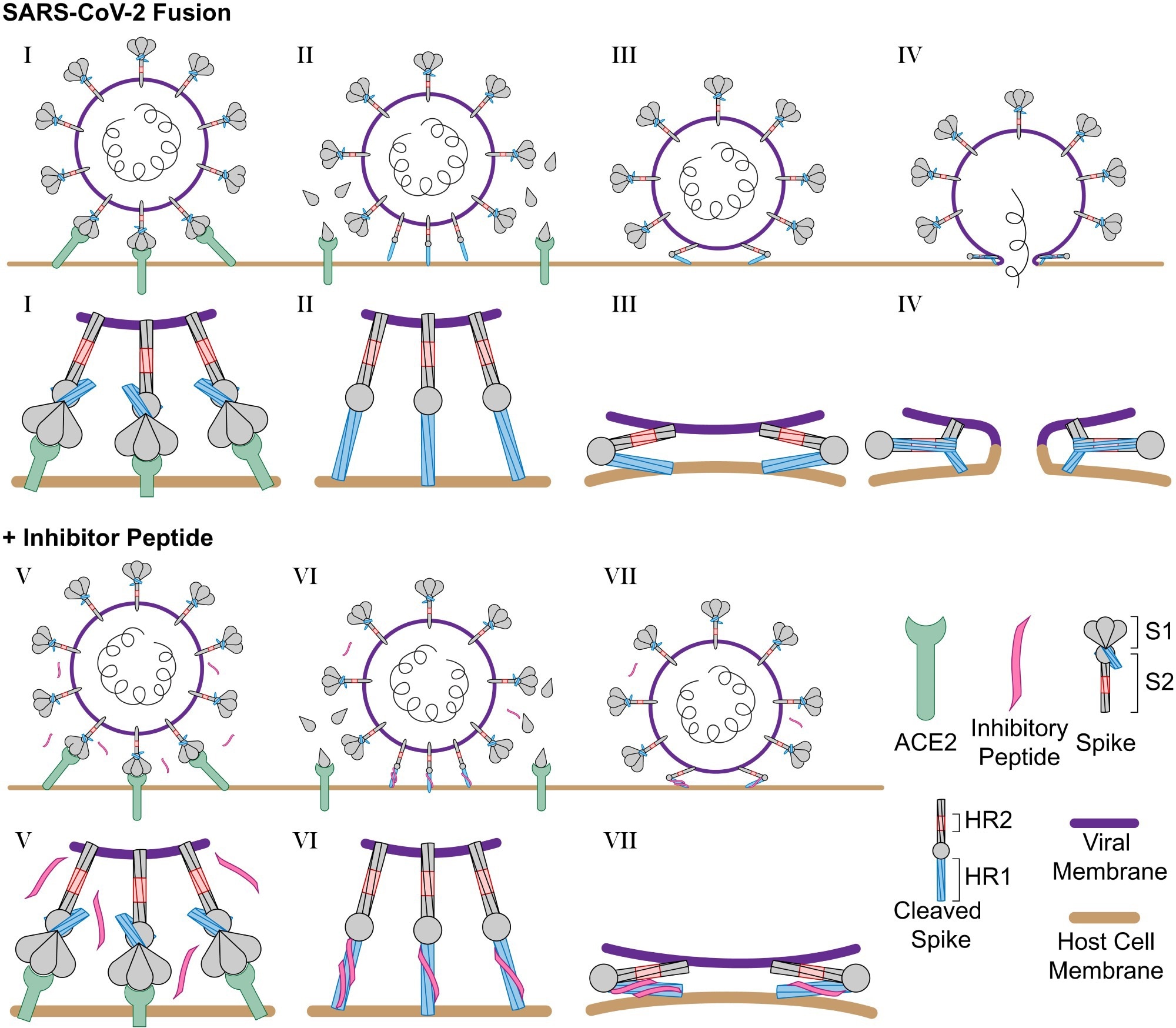
Схема заражения SARS-CoV-2 и ингибирования пептидами HR2. (I) SARS-CoV-2 связывается с рецептором клетки-хозяина ACE2 посредством взаимодействия с доменом S1 белка S. (II) После расщепления протеазами клетки-хозяина домен S1 высвобождается, а домен S2 белка S проникает в мембрану клетки-хозяина. (III) Запускаемый слегка кислым рН домен S2 сворачивается назад, сближая мембраны вируса и клетки-хозяина, и (IV) сворачивание доменов HR1 и HR2 катализирует слияние вирусной мембраны с мембраной клетки-хозяина. (V) В присутствии ингибитора longHR2_42 белок S взаимодействует с рецептором клетки-хозяина аналогичным образом, где (VI) после расщепления ингибитор longHR2_42 связывает домен HR1, который (VII) предотвращает свертывание доменов HR1 и HR2 вместе. и блокирует слияние мембран. В этой модели
По сравнению с Delta VOC значения IC 50 различались почти в пять раз между анализом инфекции VSV-SARS-CoV-2 и аутентичным анализом инфекции SARS-CoV-2.
Кроме того, исследователи отметили, что longHR2_42 не показал соответствующего увеличения кажущейся аффинности к HR1 во всех трех анализах связывания, описанных в исследовании. Есть два возможных объяснения одного и того же. Во-первых, эти анализы не были достаточно чувствительными, чтобы обнаруживать небольшие изменения аффинности. Однако более вероятно, что другие факторы повлияли на эффективность пептидов, полученных из HR2, против SARS-CoV-2.
Визуализация одного вируса показала, что для слияния SARS-CoV-2 с рецепторами клеток-хозяев необходимо от 9 до 12 белков S; следовательно, один ингибирующий белок может предотвратить слияние. Кроме того, для расщепления S-белка требуется трансмембранная протеаза серин 2 ( TMPRSS2 ) или катепсин. Поскольку исследователи добавили ингибитор динамина dynasore-OH для ингибирования катепсина в экспериментах по вымыванию, они установили промежуточное соединение SARS-CoV-2 S до шпильки для связывания пептидов. Таким образом, в отсутствие TMPRSS2 вирус и пептид имели слабую ассоциацию, что ограничивало время ингибирования только 15-20 минутами. Тем не менее, наблюдаемая повышенная аффинность longHR2_42 не зависела от протеаз клетки-хозяина, необходимых для расщепления S.
Выводы
Спиральная область HR2 вируса SARS-CoV-2 показала, что она потенциально может быть источником мощных пептидных терапевтических средств против SARS-CoV-2, которые будут работать против его летучих органических соединений и более отдаленно родственных вирусов. Кроме того, пептид longHR2_42 имел длительное время ингибирования (более трех часов), несмотря на вымывание в анализах на вирусную инфекцию, что позволяет предположить, что он нацелен на промежуточное соединение S-белка SARS-CoV-2, предшествующее шпильке. Действительно, данные исследования предоставили дополнительную поддержку промежуточному продукту S-гликопротеина SARS-CoV-2, предшествующему шпильке.
По мнению авторов, расширение последовательности пептида longHR2_42 может повысить его эффективность. Кроме того, оптимизация его последовательности может еще больше повысить его активность и предоставить платформу для разработки других новых пептидов, специфичных для варианта SARS-CoV-2.























Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.