Летучие мыши эволюционировали с уникальными особенностями, такими как ларингеальная эхолокация и полет, причем некоторые из них способны переносить вирусы, такие как коронавирусы тяжелого острого респираторного синдрома (SARS-CoV), ближневосточный респираторный синдром CoV (MERS-CoV), а также вирусы Марбург и Нипах. . Разработка надежных клеточных моделей летучих мышей могла бы обеспечить лучшее понимание обращения с вирусами летучих мышей и их биологии.
В недавнем исследовании, опубликованном на сервере препринтов bioRxiv *, исследователи создали индуцированные плюрипотентные стволовые клетки (ИПСК) из летучих мышей Rhinolophus ferrumequinum , используя модифицированный протокол Yamanaka, чтобы установить летучих мышей в качестве нового вида для изучения модели in vivo .
Исследование: плюрипотентные стволовые клетки летучих мышей обнаруживают уникальную связь между хозяином и вирусами. Изображение предоставлено: Джезпер / Shutterstock.com
Об исследовании
В настоящем исследовании ученые выясняют, могут ли летучие мыши быть пригодными для производства вирусов.
Использовался подход к перепрограммированию Яманаки, основанный на факторах перепрограммирования, таких как ген Y-box 2 области, определяющей пол, октамер-связывающий фактор транскрипции 4 (Oct4), cMyc и Kruppel-подобный фактор 4 (Klf4).
Клетки эмбриональных фибробластов летучих мышей (BEF) были выделены из R. ferrumequinum с измененным количеством факторов перепрограммирования для активации и блокирования нескольких сигнальных путей. Кроме того, также были проведены анализы иммуноокрашивания и секвенирования рибонуклеиновой кислоты (РНК) (RNA-seq).
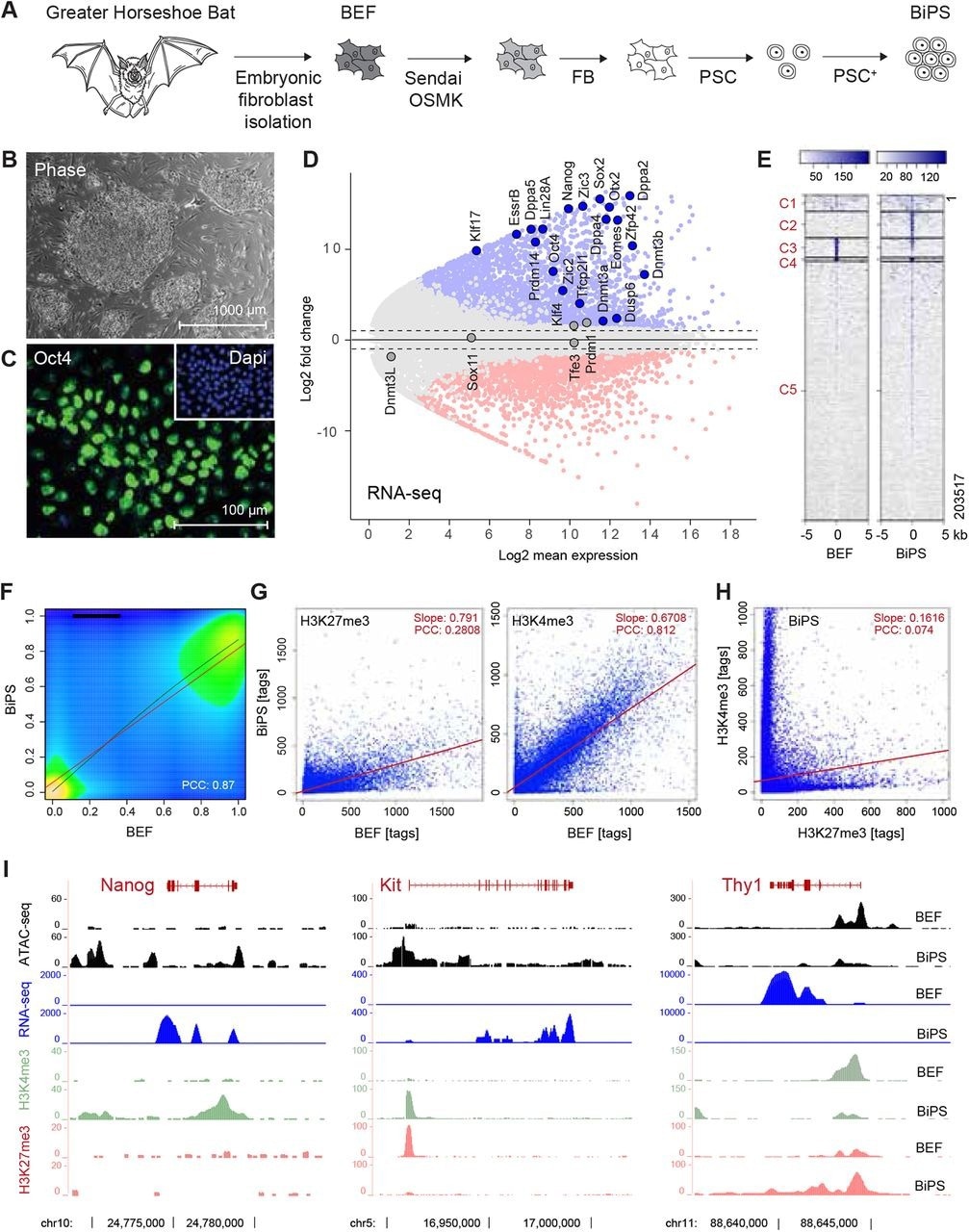
Получение плюрипотентных стволовых клеток летучих мышей.(A) Иллюстрация стратегии получения плюрипотентных стволовых клеток летучих мышей. BEF, эмбриональные фибробласты; ОСМК, Oct4, Sox2, cMyc, Klf4; FB, среда для фибробластов; PSC, среда для плюрипотентных стволовых клеток; PSC+, PSC с добавками. (B) Морфология установленных колоний клеток BiPS, выращенных на эмбриональных фибробластах мыши. (C) Иммунофлуоресцентное обнаружение Oct4 в клетках BiPS. (D) График MA данных RNA-seq, иллюстрирующий различия в транскрипции между эмбриональными фибробластами летучих мышей (BEF) и плюрипотентными стволовыми клетками (BiPS). Выделены выбранные гены с известными функциями в установлении или поддержании плюрипотентности. (E) Кластерный анализ Kmean сигналов ATAC-seq, полученных от клеток BEF или BiPS. С, кластер. (F), график плотности результатов RRBS, полученных из клеток BEF и BiPS. PCC, коэффициент корреляции Пирсона. (G) Графики рассеяния статуса метилирования гистона 3 на уровне K4 (активирующая модификация хроматина) или K27 (репрессирующая модификация хроматина) после ChIP-seq из клеток BEF или BiPS, как указано. (H) Диаграмма рассеяния H3K4me3 и H3K27me3 в клетках BiPS, иллюстрирующая появление участков двухвалентного хроматина в клетках BiPS. (I) Сигналы RNA-seq, ATAC-seq и H3K4me3 или H3K27me3 ChIP-seq выбранных генов с известными ролями в перепрограммировании, которые активированы (Nanog, Kit) или репрессированы (Thy1) в BiPS по сравнению с клетками BEF.
Влияние модифицированного метода репрограммирования на эпигенетические молекулы и хроматин летучих мышей оценивали с помощью анализа доступного для транспозазы хроматина с секвенированием (ATAC-seq). Также были проведены анализ картирования метилома дезоксирибонуклеиновой кислоты (ДНК) и анализы иммунопреципитации и секвенирования хроматина (ChIP-seq). Протоколы были оптимизированы для обеспечения дифференцировки СК летучих мышей в три зародышевых листка, тогда как анализ дифференцировки эмбриональных тел (ЭТ) проводился для оценки плюрипотентности.
ИПСК летучих мышей (BiPSC) впоследствии вводили мышам с подавленным иммунитетом, и из BiPS создавали структуры, подобные эмбрионам. Протокол исследования был подтвержден путем разработки клеток BiPS эволюционно далеких летучих мышей Myotis myotis.
Сравнительное профилирование транскрипционных генов и анализ основных компонентов (PCA) были выполнены на видах летучих мышей Rhinolophus и филогенетически различных видах млекопитающих мышей, людей, собак, свиней и мартышек.

Optimum Nutrition, Opti-Men, 150 таблеток
Анализ генной онтологии был проведен для оценки передового обогащения генов для конкретных биологических путей. Новые конвейеры были разработаны на основе метагеномной классификации данных секвенирования рибонуклеиновой кислоты (РНК) стволовых клеток (RNA-seq), предполагаемой сборки ретровирусных контигов de novo и геномного картирования для выявления истинных ретровирусных прочтений. Кроме того, были исследованы антигенные маркеры, относящиеся к РНК-вирусам.
Результаты исследования
Особое соотношение репрограммирующих факторов, а также добавление в культуральную среду фактора роста фибробластов-2 (Fgf-2), фактора стволовых клеток (Scf), фактора, ингибирующего лейкемию (Lif) и форсколина, обеспечили неингибируемый рост BiPSC с однородным и плотным колонии летучих мышей появляются в течение 14-16 дней.
БиПСК экспрессировали фактор плюрипотентности Oct4 со скоростью пролиферации, идентичной скорости пролиферации ПСК человека. Большинство клеток содержало 56 хромосом и реплицировалось без экзогенных репрограммирующих факторов и морфологических изменений.
БиПСК дифференцировались в три зародышевых листка, впоследствии формируя ЗТ и органоиды. Анализ РНК-секвенций показал индуцированную эндогенную экспрессию канонических генов, связанных с плюрипотентностью, таких как SRY-2, Nanog и Oct4.
Однако генетический профиль не полностью соответствовал одному состоянию плюрипотентности. Вместо этого были экспрессированы наивные факторы плюрипотентного состояния, такие как Klf4 и 17, бета-белок рецептора, связанного с эстрогеном (Essrb), фактор транскрипции E3 (Tfe3) и фактор транскрипции CP2 Like 1 (Tfcp2l1)]. Наблюдались коэкспрессированные Tfcp2l1/белок цинкового пальца (Zic2) и гомеобокс 2 ортодентикул (Otx2)/Tfe3 и праймированные/наивные факторы.
Изменения конфигурации хроматина и метилирования CpG 191 наблюдались в геноме летучей мыши. Результаты ChiP-seq показали перекрытие между генами бивалентности человека и летучей мыши, хотя некоторые гены были видоспецифичными.
БиПСК были перепрограммированы транскрипционно и эпигенетически. BIPSC были положительными по маркерам парного белка (Pax6), 213T и альфа-фетопротеина (AFP) для эктодермы, мезодермы и энтодермы, соответственно.
Ген ERAS был подавлен, тогда как гены гиалуронидазы и фактора рибозилирования АДФ (ARF) были неразличимы между группами. Бластоиды Rhinolophus показали эмбриональные структуры, прикрепленные к уплощенному трофобластическому эпителиальному отростку и расширению внутренней клеточной массы. Выводы летучих мышей Myotis показали, что протокол исследования может применяться к различным видам летучих мышей.
Анализ РСА показал наличие отдельной группы стволовых клеток летучих мышей. Однако только восемь передовых генов показали значительную положительную селекцию в R. ferrumequinum , при этом большинство генов принадлежат к неожиданным категориям. Более того, заболевание CoV было наиболее значительно обогащенной категорией в Киотской энциклопедии путей генов и геномов (KEGG).
Гены коллагена III альфа 1 (Col3a1) и муцина 1 (Muc1) были обнаружены в BiPSCs, что указывает на специфичные для летучих мышей генетические адаптации. Репрограммирование выявило последовательности эндогенного ретровируса (ERV).
БиПСК содержали несколько связанных с вирусом эндогенных последовательностей с областями, гомологичными вирусу герпеса человека 4, респираторно-синцитиальному вирусу человека и изоляту SARS-CoV-2. Геномные последовательности R. ferrumequinum напоминали последовательности человеческого CoV 229E и человеческого CoV OC43.
Было идентифицировано несколько сайтов интеграции ретровирусов, которые были гомологичны вирусам, таким как вирус обезьян Mason-Pfizer, вирус Koala и ретровирус овец Jaagsiekte. Геном был гомологичен вирусам волепокса, натуральной оспы, оспы белок, оспы обезьян и вирусам синдрома белых пятен.
Выводы
Последовательности BiPSC были аналогичны последовательностям вирусного генома. Таким образом, транскрипционно пермиссивное состояние плюрипотентности летучих мышей может быть использовано для обнаружения новых последовательностей вирусов летучих мышей, участвующих в физиологии летучих мышей, и их способности к размещению вирусов.
*Важное замечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются экспертами и, следовательно, не должны рассматриваться как окончательные, направляющие клиническую практику/поведение, связанное со здоровьем, или рассматриваться как установленная информация.
























Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.