В недавнем исследовании, опубликованном на сервере препринтов medRxiv *, исследователи из Австралии определили, вызывает ли тяжелый острый респираторный синдром коронавирус 2 (SARS-CoV-2) Delta-ORF7a Δ17del [белок с открытой рамкой считывания 7a с 17-нуклеотидным (nt) сдвигом рамки считывания. делеция] вариант имеет преимущество в приспособленности по сравнению с вариантом Delta, в котором отсутствует делеция ORF7a Δ17del (Delta-ORF7a интактная ) и/или линия SARS-CoV-2 (A.2.2).
О делециях белка ORF7a SARS-CoV-2 (del) сообщалось с начала периода пандемии коронавирусной болезни 2019 (COVID-19). Вспышки дельты произошли в Австралии с июня 2021 г. по февраль 2022 г., и полногеномное секвенирование (WGS) возбудителя дельта-варианта показало усечение ORF7a из-за наличия делеции из 17 нуклеотидов, вызывающей сдвиг рамки считывания.
Исследование : Постоянство варианта SARS-COV-2 с удалением фрейм-съемки в течение всей серьезной вспышки . Кредит изображения: Пунктирный йети / Shutterstock
Об исследовании
В настоящем ретроспективном исследовании ученые исследовали устойчивость ORF7a Δ17del в течение нескольких месяцев, в отличие от других мутаций в ORF7a, которые были обнаружены во всем мире в дельта-геномах. Они исследовали, продуцирует ли Delta-ORF7a Δ17del обнаруживаемый/функциональный белок, место локализации ORF7a в инфицированных клетках и оценили рост ORF7aΔ17del in vitro .
Все геномы поля GK (преимущественно содержащие геномы Delta) были загружены из базы данных GISAID (глобальная инициатива по обмену всеми вирусами гриппа). В каждом геноме в наборе данных был проведен поиск ORF7a del путем сопоставления каждой последовательности с эталонным геномом Wuhan Hu-1 SARS-CoV-2. Впоследствии геномы отбрасывались, если они не относились к Delta, были дубликатами, не охватывали весь ген ORF7a и/или не были указаны даты сбора.
Структурное моделирование и анализ докинга белка были выполнены для ORF7a. Кроме того, клетки Calu-3 (клеточная линия карциномы легких) инфицировали 10 3 TCID 50 (50% инфекционная доза культуры ткани) A.2.2, интактной Delta-ORF7a или Delta-ORF7a Δ17del , и для клеток проводили вестерн-блот-анализ . супернатанты инфицированных и неинфицированных клеток. Кроме того, проводили иммунофлуоресцентный анализ для оценки роста вируса in vitro и сравнивали среднюю интенсивность флуоресценции (MFI) окрашивания и паттерны экспрессии ORF7a в клетках, инфицированных A.2.2, и клетках, инфицированных Delta-ORF7a Δ17del .
Полученные результаты

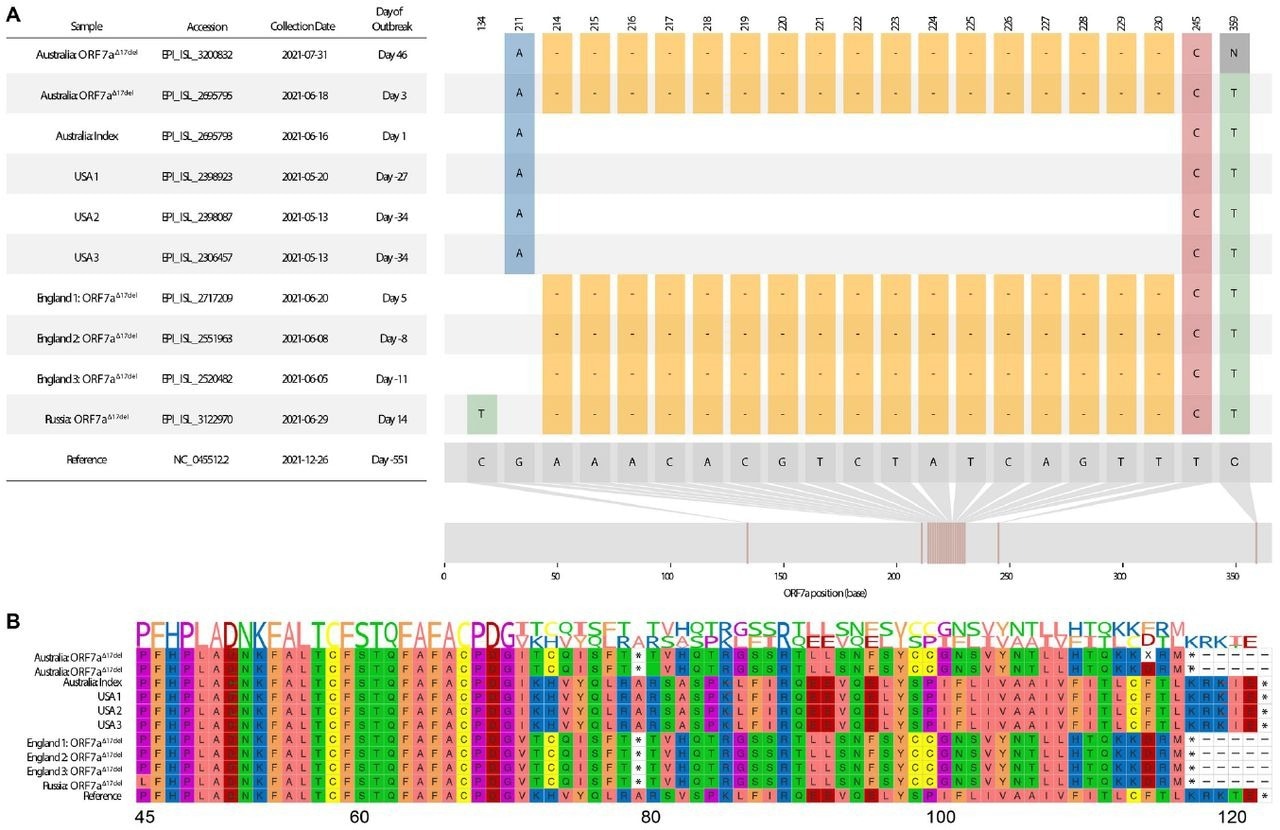
Всего из базы данных GISAID было загружено 4 018 216 дельта-геномов, из которых было идентифицировано 4 195 различных паттернов, а 3,4% (n = 134 751) содержали делецию ORF7a, наиболее распространенной из которых была мутация ORF7a Δ17del . Почти все (99%) геномы Delta-ORF7a Δ17del произошли от вспышки в Австралии и составили 87% (27912 из 32048) геномов вспышки.
Эксперименты in vitro показали значительно более высокую долю клеток, инфицированных Delta-ORF7a Δ17del , по сравнению с клетками, инфицированными интактной Delta-ORF7a , и A.2.2, что свидетельствует о незначительном преимуществе роста Delta-ORF7a Δ17del по сравнению с интактной Delta-ORF7a . Штаммы Delta-ORF7a Δ17del продуцировали ORF7a, хотя и в значительно меньших количествах по сравнению с A.2.2, с более диффузным характером экспрессии по всей цитоплазме инфицированных клеток.
Было подсчитано, что более 70% ORF7a del вызывают сдвиг рамки считывания, который может привести к преждевременному стоп-кодону и укороченной последовательности аминокислот (аа). Del обычно идентифицировали в течение коротких периодов времени (в среднем один день), при этом наиболее устойчивой в кадре del является 12-нуклеотидная del из 27 617–27 628 оснований среди 99 геномов, отобранных в период с 11 августа по 12 января 2022 г., с Разница во времени 519 дней. del, вызывающие сдвиг рамки, обычно преходящи; однако некоторые из них можно было отобрать в течение длительного периода, например, 64-нуклеотидная делеция, охватывающая более 27 556–27 619 позиций, была обнаружена в 8945 последовательностях, отобранных в период с 20 марта 2021 г. по 22 февраля 2022 г., с разницей во времени 339 дней.
Наиболее часто обнаруживаемая ORF7a del соответствовала положениям между 27607 и 27623, как идентифицировано в геномах Delta-ORF7a Δ17del . 17-нуклеотидная del Delta-ORF7a Δ17del произошла после шестого β(beta)-листа, вызывая потерю С-концевого трансмембранного домена, седьмого β-листа и определяющего локализацию ER цитоплазматического мотива KRKTE.
Кроме того, это привело к потере ORF7a:K119 aa и ингибированию интерферона типа I (IFN-I) посредством блокады преобразователя сигнала и активатора транскрипции 2 (STAT2). По оценкам, потеря ORF7a:K119 aa снижает титры репликации варианта Delta-ORF7a Δ17del . Сохранение 17 nt-del и N-концевого пептида может увеличить секрецию ORF7a и изменить вариант патологии Delta-ORF7a Δ17del , поскольку ORF7a обычно сохраняется на клеточных поверхностях и внутриклеточно в мембране ER и аппарате Гольджи. Белок ORF7A варианта Delta-ORF7a Δ17del мог связываться с кластером дифференцировки 14 (CD14); однако седьмой β-лист и потеря K119 вызвали значительные изменения в областях взаимодействия.
Белки шипа (S) и нуклеокапсида (N) SARS-CoV-2 были обнаружены во всех вариантах клеточных супернатантов, но не в неинфицированных клетках. Около 79%, 61% и 67% клеток, инфицированных Delta-ORF7a∆17del , Delta-ORF7a интактной и A.2.2, были N-позитивными по SARS-CoV-2 соответственно, тогда как неинфицированные клетки не имели SARS-CoV- 2 Н положительный.
Окрашивание MFI ORF7a среди клеток, инфицированных Delta-ORF7a Δ17del и A.2.2, составляло 70,7 и 74,4 соответственно, а среди неинфицированных клеток ORF7a не обнаруживалась. Основными вероятностями, объясняющими персистенцию Delta-ORF7a Δ17del в Австралии, были (i) отсутствие конкуренции со стороны интактной Delta-ORF7a и других циркулирующих вариантов, и (ii) мутация ORF7a Δ17del не может быть вредной для Delta.
В целом результаты исследования показали, что пролиферация генома Delta-ORF7a Δ17del во время вспышки австралийской дельты, скорее всего, произошла из-за случайных эффектов основателя, а не из-за внутреннего преимущества мутации ORF7a Δ17del . Тем не менее, обилие делеций ORF7a в геномах во всем мире указывает на некоторые потенциальные преимущества дельта-передачи. Кроме того, результаты показали, что ORF7a является горячей точкой для генома SARS-CoV-2 del; однако необходимы дальнейшие геномные эпидемиологические исследования.
*Важное замечание
medRxiv публикует предварительные научные отчеты, которые не рецензируются экспертами и, следовательно, не должны рассматриваться как окончательные, направляющие клиническую практику/поведение, связанное со здоровьем, или рассматриваться как установленная информация.






















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.