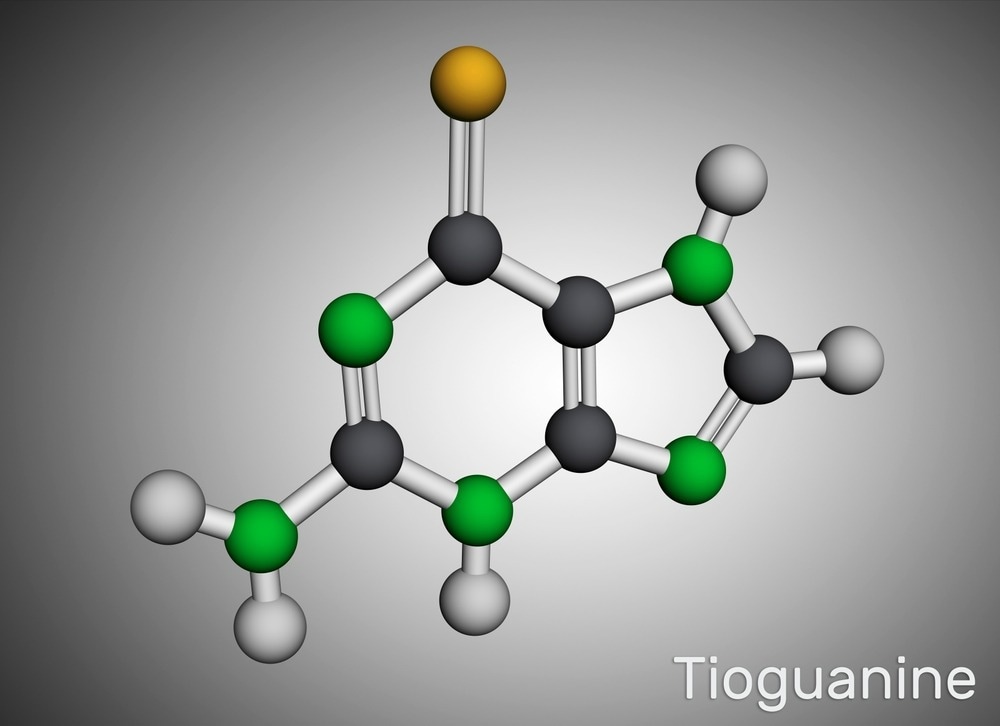
В недавнем исследовании, опубликованном в журнале PLoS Pathogens , исследователи описали новый противовирусный механизм действия тиопурина, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), известного как 6-тиогуанин (6-ТГ).
Фон
Пандемия тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2) стимулировала усилия по перепрофилированию лекарств для разработки эффективных и безопасных противовирусных препаратов. Противовирусные препараты, нацеленные на хозяина (HTA), косвенно ингибируют репликацию вируса, ингибируя клеточные процессы хозяина и/или стимулируя противовирусные ответы.
Авторы настоящего исследования ранее продемонстрировали, что тиопурины, 6-тиогуанозин (6-TGo) и 6-TG ингибируют репликацию IAV (вируса гриппа А) за счет активации реакции развернутого белка (UPR) и препятствуют процессингу и накоплению вирусного гликопротеина.
Об исследовании
В настоящем исследовании изучалось, могут ли 6-TG и другие тиопурины влиять на гликопротеины коронавируса (CoV) .
Оценивалась эффективность тиопурина в отношении тяжелого SARS-CoV-2, ингибирования репликации человеческого CoV (HCoV)-OC43 и HCoV-229E и нарушения синтеза вирусной рибонуклеиновой кислоты (РНК). Эксперименты с клеточными культурами проводили с использованием клеток 293T, HCT-8 ( клеточная линия илеоцекальной аденокарциномы человека ), Huh7.5 (клеточная линия, полученная из гепатомы человека), фибробласта, иммортализованного первичной теломеразной обратной транскриптазой человека (hTERT), и Calu-3 (аденокарцинома легкого). клеточная линия) клетки.
Кроме того, высвобождение вирусных частиц оценивали с помощью количественного анализа внеклеточных вирусных геномов методом полимеразной цепной реакции с обратной транскрипцией (RT-qPCR). Анализ иммуноокрашивания с использованием клеток, инфицированных HCoV-OC43, проводили на антитела против нуклеокапсида (N) и двухцепочечную РНК (дцРНК). Были проведены анализы рибопуромицинилирования, и клетки 293T были трансфицированы плазмидами, кодирующими структурные белки SARS-CoV-2, такие как N, шип (S), мембранный (M) и оболочечный (E) белки, чтобы оценить влияние 6-TG на SARS. -Структурные белки CoV-2.
Кроме того, S SARS-CoV-2 был эктопически экспрессирован и оценен в отношении множественных концентраций 6-TG, после чего был проведен иммуноблоттинговый анализ с псевдовирионами (PV). S-экспрессирующие клеточные лизаты 293T обрабатывали PNGase F (пептид-N-гликозидаза) для удаления N-связанных гликанов из полипептидных цепей, а эффекты 6-TG на секреторный путь оценивали с помощью анализа люциферазы Gaussia.

Gaia Herbs, эхинацея и желтокорень, 60 веганских жидких фито-капсул
Анализ проточной цитометрии (FC) и окрашивание поверхности S-экспрессирующих клеток 293T проводили для измерения секреции S, и клетки котрансфицировали плазмидами EGFP+ (усиленный зеленый флуоресцентный белок) для оценки изменений в накоплении S-белка.
Кроме того, была проведена котрансфекция клеток структурными белками и плазмидами SARS-CoV-2, чтобы выяснить механизмы дефектной сборки, и команда определила, вызывают ли какие-либо известные мишени 6-TG дефекты созревания S-белка. Команда также оценила потенциальные морфологические изменения HCoV после лечения 6-TG с помощью анализа просвечивающей электронной микроскопии (ПЭМ).
Полученные результаты
6-ТГ ингибировал начальную стадию репликации SARS-CoV-2 и HCoV-OC43, ограничивая накопление полноразмерного вирусного генома, структурных белков и субгеномной РНК. Анализ эктопической экспрессии S показал повышенную электрофоретическую подвижность белка S из нескольких βCoV при обработке 6-TG в соответствии с ферментативным удалением N-связанного олигосахарида in vitro из белка S. В VLP SARS-CoV-2 (вирусоподобные частицы) в клетках, обработанных 6-TG, отсутствовал белок S.
Сходные эффекты 6-TG наблюдались при продукции S-псевдотипированного лентивируса SARS-CoV-2, приводя к S-дефицитным псевдовирусам, которые не могли инфицировать клетки, экспрессирующие ангиотензинпревращающий фермент 2 (ACE2). Полученные данные показали, что обработка 6-TG приводила к дефектному процессингу и переносу S-белка и, таким образом, препятствовала сборке инфекционного потомства вируса. Однако превращение 6-TG в его нуклеотидную (nt) форму с помощью HPRT1 (гипоксантинфосфорибозилтрансферазы 1) было необходимо для противовирусной активности, которую можно было преодолеть с помощью ML099, агониста гуанозин-5′-трифосфата (GTP)азы.
Никакие ингибиторы ГТФазы [Ras-родственный субстрат ботулинического токсина C3 1 (Rac1), член семейства гомологов Ras A (RhoA) и гомолог белка 42 контроля клеточного деления (CDC42)] не влияли на накопление или процессинг S, что указывает на то, что 6-TG ингибирует созревание S. путем ингибирования неизвестной клеточной ГТФазы. 6-TG, 6-тиогуанозин (6-TGo) и 6-меркаптопурин (6-MP) вызывали четырехлогарифмическое снижение высвобождения вириона SARS-CoV-2, а 6-TGo продемонстрировало сопоставимое ингибирование HCoV-OC43 и HCoV-229E, тогда как 6-MP был неэффективен. Анализ RT-qPCR показал, что лечение 6-TG снижало титры HCOV-OC43 в 20 раз в первый день заражения.
Предполагаемая полноразмерная геномная вирусная РНК уменьшалась в 10 раз на большинстве стадий инфекции. Лечение 6-TG вызывало аналогичное снижение вирусной S- и N-кодирующей субгеномной РНК, коррелирующее с более низким накоплением белка. Иммуноокрашивание клеток, инфицированных HCoV-OC43, анти-N-антителами вначале показало точечное окрашивание, а затем — периферическое окрашивание. После обработки 6-TG окрашенные области были ярче, с большими точками, наблюдаемыми через 24 часа после заражения (hpi). Иммуноокрашивание на дцРНК показало значительно сниженные сигналы дцРНК среди клеток, обработанных 6-ТГ.
6-ТГ задерживает или подавляет транскрипционные ответы UPR ниже по течению, но не влияет на скорость инициации трансляции в клетках, инфицированных HCoV-OC43. Ингибирование 6-TG инфекции HCoV-OC43 ограничивало активацию инозитол-требующего фермента 1 (IRE1) и накопление гена-мишени X-box-связывающего белка 1 (XBP1s). Полученные данные показали, что, хотя 6-TG вмешивался в синтез полноразмерной геномной и субгеномной РНК вируса, отключение хозяина не нарушалось.
6-ТГ снижал экспрессию структурного белка SARS-CoV-2 (особенно S), и иммуноблоттинговый анализ показал S-полосу с высокой молекулярной массой, характерную для белка-предшественника S0, который также был чувствителен к обработке PNGaseF. Результаты анализа электрофоретической подвижности показали, что 6-TG ингибирует гликозилирование и процессинг S, а эксперименты с люциферазой Gaussia показали, что 6-TG не вызывает нарушения глобального секреторного пути. Анализ TEM показал меньшее количество вирусных частиц в клетках, обработанных 6-TG.
Вывод
В целом, результаты исследования выявили малые ГТФазы в качестве потенциальных мишеней HTA, а эффекты 6-TG на S в нескольких моделях, такие как эктопическая экспрессия, аутентичные инфекции HCoV и продукция PV и VLP, указывают на противовирусный механизм, помимо папаиноподобного. ингибирование протеазы (PLpro).



















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.