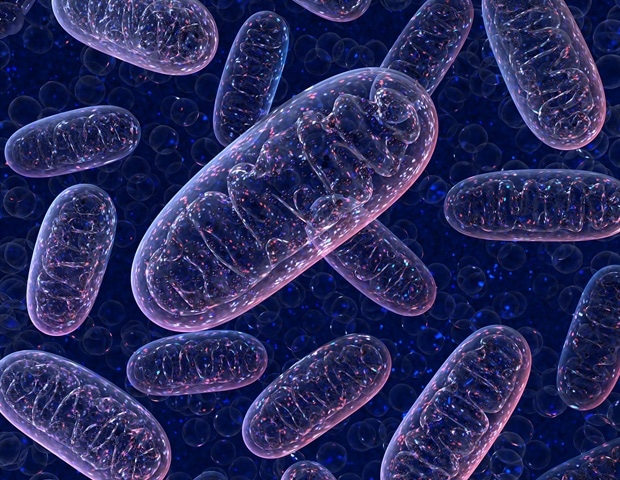
Новое исследование, посвященное клеткам Th17 иммунной системы, предполагает, что форма и функция их митохондрий (электростанции клеток) важны при аутоиммунных и воспалительных заболеваниях, таких как рассеянный склероз. Т-хелперы 17 (Th17) представляют собой тип CD4+ Т-иммунных клеток, которые в совокупности помогают вырабатывать антитела, активировать клетки, поедающие врага, и набирать больше солдат на поле боя.
Исследование, проведенное Эрикой Пирс, доктором философии, в Институте иммунотерапии рака Блумберга-Киммеля при Онкологическом центре имени Джона Хопкинса Киммела, предполагает, что изучение того, как митохондрии влияют на клетки Th17, является ключом к пониманию того, как их контролировать.
Исследование, опубликованное 28 сентября в журнале Nature , определяет несколько способов повлиять на поведение этих важных клеток с целью ослабления их аутоиммунной активности.
Когда Т-клетка впервые подвергается воздействию врага, она реагирует на сигналы от врага и окружающей среды, чтобы стать одним из нескольких типов специализированных Т-клеток , каждая из которых выполняет определенные функции в иммунном ответе. Хотя все подтипы Т-хелперов имеют решающее значение для борьбы организма с чужеродными веществами, их дисбаланс также может вызывать заболевания, включая диабет 1 типа, астму, аллергии и хронические воспаления.
«Если бы мы могли контролировать Т-клетки, мы, возможно, смогли бы контролировать многие, если не большинство, инфекций, аутоиммунных заболеваний и рака», — говорит Пирс, старший автор исследования и заслуженный профессор Блумберга Университета Джонса Хопкинса на кафедре онкологии и биохимии и биохимии. Молекулярная биология.

Himalaya, Пищевая добавка GlucoCare, 180 растительных капсул
Исследование началось, когда исследователи из лаборатории Пирса, которая тогда находилась в Институте Макса Планка во Фрайбурге, Германия, заметили особенность, присущую клеткам Th17. Среди трех основных типов эффекторных Т-клеток только клетки Th17 имели удлиненные митохондрии; то есть их внутренние силовые установки были объединены в более крупные конструкции. «Это было странно, потому что удлиненные митохондрии обычно наблюдаются в покоящихся клетках, а не в активированных», — говорит первый автор Франсеск Байшаули, доктор философии, бывший научный сотрудник Института Макса Планка.
Исследователи знали, что ген OPA1 регулирует слияние митохондрий, поэтому они удалили его в клетках Th17 и обнаружили, что их митохондрии вернулись к более фрагментированному размеру и форме. Однако клетки также перестали выполнять свою основную работу — ; производство сигнальной молекулы интерлейкина-17 (ИЛ-17).
Чтобы подтвердить этот результат в организме, исследователи удалили ген OPA1 у мышей и стимулировали заболевание у этих животных, которое моделирует рассеянный склероз человека, которым управляют их клетки Th17. После удаления OPA1 их клетки не только перестали вырабатывать IL-17, но и уменьшились симптомы заболевания.
Задаваясь вопросом, как делеция OPA1 остановила выработку IL-17, команда сначала подумала, что митохондрии клеток просто не производят достаточно энергии. Однако они обнаружили, что делеция OPA1 не влияет на выработку энергии и что OPA1 имеет решающее значение для производства IL-17 независимо от того, была ли метаболическая активность клеток высокой или низкой. Затем они обнаружили, что центральный биохимический процесс, происходящий в митохондриях, был изменен, что привело к накоплению метаболита, который, как известно, влияет на ДНК и программу транскрипции клетки. «Эта молекула ослабляла способность клетки читать свою ДНК, и, следовательно, IL-17 больше не производился», — говорит Байксаули.
Чтобы определить связь между этими ответами и делецией OPA1, исследователи сравнили белки, продуцируемые нормальными клетками Th17 и клетками без OPA1. В клетках, в которых отсутствует OPA1, они обнаружили значительное увеличение активированной формы белка LKB1, который является метаболическим сенсором, регулирующим клеточный метаболизм, деление клеток и функцию митохондрий. Когда они удаляли из клеток и OPA1, и LKB1, продукция IL-17 восстанавливалась, и митохондриальные процессы возвращались к норме.
Мы думаем, что LKB1 ощущает митохондриальный стресс и соответствующим образом изменяет биохимические реакции митохондрий, что влияет на продукцию IL-17. Теперь у нас есть краткий список молекул, которые, как известно, влияют на этот ключевой аспект функции Th17, что может быть переломным моментом между его полезной и вредной ролью. Наши будущие исследования продолжат изучать эти отношения, чтобы однажды мы могли изменить их терапевтически».
Эрика Пирс, доктор философии, заслуженный профессор Университета Джонса Хопкинса Bloomberg кафедры онкологии и кафедры биохимии и молекулярной биологии
Другими исследователями были Клара Пилетик, Даниэль Дж. Пулестон, Маттео Вилла, Кэмерон С. Филд, Леа Дж. Флаксманн, Андреа Кинтана, Ниша Рана, Джой Эдвардс-Хикс, Май Мацусита, Михал А. Станчак, Катажина М. Гжес, Агнешка М. Кабат, Марио Фабри, Джордж Капута, Бет Келли, Мауро Коррадо, Яаруб Муса, Катажина Дж. Дуда, Герхард Миттлер, Дэвид О’Салливан, Томас Йенувейн и Йорг М. Бюшер из Института Макса Планка, а также Хироми Сесаки, Эдвард Дж. , Пирс и Дэвид Э. Санин в Университете Джонса Хопкинса.
Исследование было поддержано Обществом Макса Планка, Премией Лейбница, Национальными институтами здравоохранения (R01AI156274 и R35GM144103), Университетом Джона Хопкинса и заслуженным профессором Блумберга, индивидуальной стипендией Марии Склодовской-Кюри Actions, стипендией сэра Генри Велкама и постдокторская стипендия Александра фон Гумбольдта.
Эрика Пирс является членом научно-консультативного совета ImmunoMet Therapeutics, а Эрика Пирс и Эдвард Пирс являются основателями и научными консультантами Rheos Medicines.





















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.