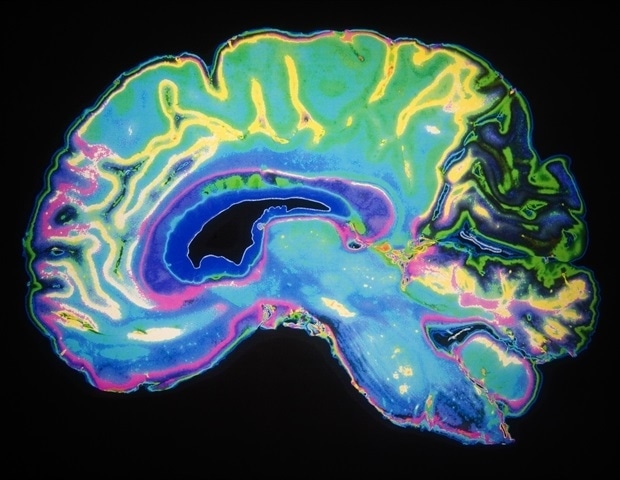
Исследователи из Швейцарской высшей технической школы Цюриха выращивают ткань, подобную человеческому мозгу, из стволовых клеток, а затем картируют типы клеток, встречающиеся в разных областях мозга, и гены, регулирующие их развитие.
Человеческий мозг, вероятно, является самым сложным органом во всем живом мире и давно привлекает внимание исследователей. Однако изучение мозга, особенно генов и молекулярных переключателей, которые регулируют и направляют его развитие, — непростая задача.
На сегодняшний день ученые продолжают использовать животных моделей, в первую очередь мышей, но их результаты не могут быть перенесены непосредственно на людей. Мозг мыши устроен по-другому и не имеет бороздчатой поверхности, типичной для человеческого мозга. Культуры клеток до сих пор имели ограниченное значение в этой области, поскольку клетки имеют тенденцию распространяться на большую площадь при выращивании на чашке для культивирования; это не соответствует естественной трехмерной структуре мозга.
Картирование молекулярных отпечатков пальцев
Группа исследователей под руководством Барбары Трейтлейн, профессора ETH на кафедре биосистемных наук и инженерии в Базеле, применила новый подход к изучению развития человеческого мозга: они выращивают и используют органоиды — трехмерные миллиметровые ткани, которые можно вырастить из так называемых плюрипотентных стволовых клеток.
При условии, что эти стволовые клетки получают правильный стимул, исследователи могут запрограммировать их на превращение в любые клетки, присутствующие в организме, включая нейроны. Когда стволовые клетки объединяются в небольшой шар ткани, а затем подвергаются соответствующему воздействию, они могут даже самоорганизоваться и образовывать трехмерный мозговой органоид со сложной тканевой архитектурой.
В новом исследовании, только что опубликованном в журнале Nature , Трейтлейн и ее коллеги изучили тысячи отдельных клеток органоида мозга в различные моменты времени и очень подробно. Их целью было охарактеризовать клетки в молекулярно-генетических терминах: другими словами, совокупность всех транскриптов генов (транскриптом) как меру экспрессии генов, а также доступность генома как меру регуляторной активности. Им удалось представить эти данные в виде карты, показывающей молекулярный отпечаток каждой клетки внутри органоида.
Однако эта процедура генерирует огромные наборы данных: каждая клетка органоида имеет 20 000 генов, а каждый органоид, в свою очередь, состоит из многих тысяч клеток. «В результате получается гигантская матрица, и единственный способ решить ее — с помощью подходящих программ и машинного обучения», — объясняет Йонас Флек, докторант группы Трейтлейна и один из ведущих авторов исследования. Чтобы проанализировать все эти данные и предсказать механизмы регуляции генов, исследователи разработали собственную программу.
Мы можем использовать его, чтобы создать целую сеть взаимодействия для каждого отдельного гена и предсказать, что произойдет в реальных клетках, когда этот ген выйдет из строя».
Йонас Флек, докторант
Выявление генетических переключателей
Целью этого исследования было систематическое определение тех генетических переключателей, которые оказывают значительное влияние на развитие нейронов в различных областях органоидов головного мозга.
С помощью системы CRISPR-Cas9 исследователи ETH выборочно отключили один ген в каждой клетке, всего около двух десятков генов одновременно во всем органоиде. Это позволило им выяснить, какую роль соответствующие гены играли в развитии органоида мозга.
«Этот метод можно использовать для скрининга генов, участвующих в заболевании. Кроме того, мы можем посмотреть, как эти гены влияют на развитие различных клеток внутри органоида», — объясняет Софи Янсен, также докторант в группе Трейтлейна и второй соавтор. — ведущий автор исследования.
Проверка формирования паттернов в переднем мозге
Чтобы проверить свою теорию, исследователи выбрали в качестве примера ген GLI3. Этот ген является чертежом одноименного фактора транскрипции, белка, который прикрепляется к определенным участкам ДНК, чтобы регулировать другой ген. Когда GLI3 выключен, клеточный механизм не может прочитать этот ген и транскрибировать его в молекулу РНК.
У мышей мутации в гене GLI3 могут приводить к порокам развития центральной нервной системы. Его роль в развитии нейронов человека ранее не изучалась, но известно, что мутации в гене приводят к таким заболеваниям, как цефалополисиндактилия Грейга и синдром Паллистера-Холла.
Замалчивание этого гена GLI3 позволило исследователям как проверить свои теоретические предсказания, так и определить непосредственно в клеточной культуре, как потеря этого гена повлияла на дальнейшее развитие органоида мозга. «Мы впервые показали, что ген GLI3 участвует в формировании паттернов переднего мозга у людей. Ранее это было показано только у мышей», — говорит Трейтлейн.
Модельные системы отражают биологию развития
«Самое интересное в этом исследовании то, что оно позволяет вам использовать данные всего генома из множества отдельных клеток, чтобы постулировать, какую роль играют отдельные гены», — объясняет она. «Что не менее интересно, на мой взгляд, так это то, что эти модельные системы, созданные в чашке Петри, действительно отражают биологию развития, которую мы знаем по мышам».
Трейтлейн также находит захватывающим то, как питательная среда может давать самоорганизующуюся ткань со структурой, сравнимой со структурой человеческого мозга, не только на морфологическом уровне, но и (как показали исследователи в своем последнем исследовании) на уровне регуляция генов и формирование паттерна. «Подобные органоиды — действительно отличный способ изучения биологии развития человека», — отмечает она.
Универсальные органоиды мозга
Преимущество исследований органоидов, состоящих из материала клеток человека, заключается в том, что результаты могут быть перенесены на человека. Их можно использовать для изучения не только фундаментальной биологии развития, но и роли генов в заболеваниях или нарушениях развития мозга. Например, Трейтлейн и ее коллеги работают с органоидами этого типа, чтобы исследовать генетические причины аутизма и гетеротопии; в последнем нейроны появляются за пределами их обычного анатомического расположения в коре головного мозга.
Органоиды также можно использовать для тестирования лекарств и, возможно, для культивирования трансплантируемых органов или частей органов. Трейтлейн подтверждает, что фармацевтическая промышленность очень заинтересована в этих клеточных культурах.
Однако выращивание органоидов требует времени и усилий. Более того, каждый скопление клеток развивается индивидуально, а не стандартизированно. Вот почему Трейтлейн и ее команда работают над улучшением органоидов и автоматизацией процесса их производства.



















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.