В недавнем исследовании, опубликованном в журнале PLoS Biology , исследователи исследовали роль защитных экзосом, содержащих ангиотензинпревращающий фермент 2 (ACE2), или «дефенсосом» в борьбе с инфекциями тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2).
Экзосомы представляют собой внеклеточные везикулы эндосомного происхождения, которые опосредуют события, участвующие в межклеточных событиях, путем транспортировки функциональных молекул, связанных с тканевым гомеостазом. Экзосомы использовались для диагностики и лечения рака; однако вопрос о том, могут ли дефенсосомы (подмножество экзосом) расширить диагностический и терапевтический спектр вирусных заболеваний, требует дальнейшего изучения.
Авторы настоящего исследования ранее показали, что дефенсосомы опосредуют иммунную защиту от бактериальных токсинов зависимым от белка аутофагии (ATG16L1) образом посредством включения белковых рецепторов на поверхности. Они также показали, что активация toll-подобного рецептора 9 (TLR9) индуцирует экзосомы в ответ на бактериальную дезоксирибонуклеиновую кислоту (ДНК) или CpG-A.
Исследование: дефенсосомы, содержащие ACE2, служат приманкой для подавления инфекции SARS-CoV-2 . Изображение предоставлено: Мелетиос Веррас / Shutterstock
Об исследовании
В настоящем исследовании исследователи изучили дефенсосомы как потенциальный биомаркер и терапевтическое средство против SARS-CoV-2.
В исследовании приняли участие 80 взрослых с подтвержденным методом ОТ-ПЦР (обратная транскрипция-полимеразная цепная реакция) острой коронавирусной инфекцией 2019 (COVID-19), госпитализированных в отделение интенсивной терапии (ОИТ) в связи с дыхательной недостаточностью с необходимостью искусственной вентиляции легких. Образцы жидкости бронхоальвеолярного лаважа (BALF) были получены от участников исследования для изучения образования и присутствия экзосом ACE2+ в нижних дыхательных путях с помощью анализа проточной цитометрии (FC).
Анализы налета определяли титры SARS-CoV-2, а анализы нейтрализации in vitro проводились с использованием культур эпителия дыхательных путей человека (HAEC) для оценки гуморального ответа антител против нуклеокапсидного (N) белка против SARS-CoV-2. Кроме того, было выполнено секвенирование РНК (RNA-seq) для анализа белка dACE2 (dACE2), а средняя интенсивность флуоресценции (MFI) была оценена для оценки вариаций поверхностных пропорций экзосом, содержащих ACE2, и экспрессии ACE2 экзосомами.
Кроме того, команда исследовала, коррелируют ли пропорции экзосом ACE2+ с такими клиническими параметрами, как пол, возраст, тяжесть COVID-19 и сопутствующие заболевания, такие как гипертония и диабет. Они также оценили возможную связь между пропорциями экзосом ACE2+ и продолжительностью пребывания в отделении интенсивной терапии, госпитализации и использования аппарата ИВЛ с использованием линейного и отрицательного биномиального моделирования.

Kyolic, Aged Garlic Extract, выдержанный экстракт чеснока с лецитином, 200 капсул
Команда оценила связь между продукцией экзосом ACE2+ и реакцией интерферона (IFN), и дифференциальный анализ генов был выполнен для людей с «высоким» уровнем ACE2 в их экзосомах или «высоким» продуцентом экзосом ACE2+. Кроме того, были проведены эксперименты с клеточными культурами с использованием клеток A549 и клеток Vero E6. Наконец, вестерн-блот-анализ и анализ FC были выполнены с использованием антител Abcam 15348 и AF933, соответственно, для обнаружения полноразмерного ACE2.
Была оценена возможная защита клеток Vero E6, инфицированных SARS-CoV-2 USA WA1/2020, с помощью предоставленных донором и индуцированных экзосом, а также был проведен анализ иммунофлуоресцентной микроскопии. Кроме того, была проведена электронная микроскопия (ЭМ), крио-ЭМ и томографический анализ для визуализации взаимодействия вириона SARS-CoV-2 и дефенсосом ACE2+.
Полученные результаты
Большинство (76%) участников были мужчинами и небелыми (54%) со средним возрастом 62 года. Диабет и гипертония были зарегистрированы у 39% и 53% участников, соответственно, и не оказали существенного влияния на экзосомы ACE2+. пропорции. Средняя продолжительность пребывания в отделении интенсивной терапии составила 48 дней. Экзосомы, содержащие более высокую экспрессию рецепторов ACE2 в ЖБАЛ тяжелобольных пациентов с COVID-19, были связаны с меньшей продолжительностью госпитализации, госпитализаций в ОИТ и использования ИВЛ.
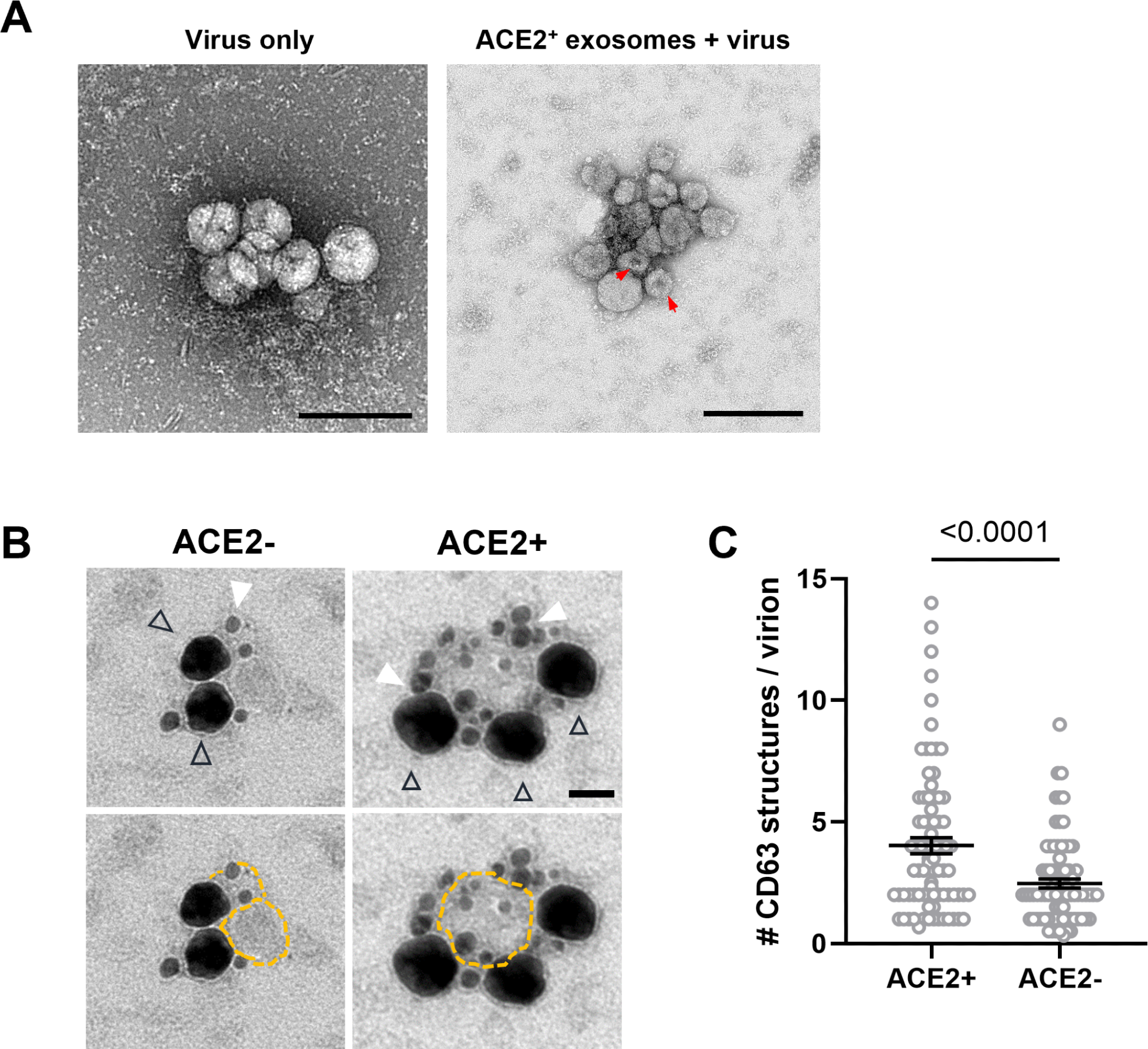
Экзосомы ACE2+ были индуцированы инфекцией SARS-CoV-2 и активацией сенсора SARS-CoV-2 в культуре клеток, для чего требовался белок ATG16L1, определяющий их как дефенсосомы. Дефенсосомы ACE2+ были напрямую связаны с SARS-CoV-2, предотвращая проникновение вируса. У десяти пациентов уровни экзосом в ЖБАЛ были в ≥2 раза выше, чем у других участников, что свидетельствует о различиях между людьми в отношении количества ACE2 на каждой экзосоме и количества экзосом ACE2+, продуцируемых каждым человеком.
Инфицирование SARS-CoV-2 клеток A549 ACE2 + индуцировало сильное производство экзосом ACE2+, которое могло быть нарушено нокдауном ATG16L1. Повреждение во время инфекций дыхательных путей привело к продукции окисленной митохондриальной ДНК (ox-mtDNA) и, следовательно, к увеличению продукции экзосом. У CpG-B отсутствовал фосфодиэфирный остов, что приводило к плохой индукции интерферона (IFN) и отказу индукции экзосом.
IFN-α, IFN-λ2 и эктопическая продукция TLR7 (при стимуляции R848) индуцировали экзосомы, тогда как IFN-β не индуцировал экзосомы из клеток A549 с тройным нокаутом (TKO), в которых отсутствовали основные рецепторы для распознавания IFN I, III и III типов. . Клетки TKO A549 продуцировали экзосомы в ответ на CpG-A. Напротив, сенсоры цитозольной рибонуклеиновой кислоты (РНК) MDA-5 ( белок 5, ассоциированный с дифференцировкой меланомы ) и RIG-I (ген I, индуцируемый ретиноевой кислотой) не индуцировали экзосомы.
Полноразмерный ACE2 был легко обнаружен с использованием антител AF933 и Abcam 15348, что указывает на то, что полноразмерный ACE2 включен в экзосомы, полученные из ЖБАЛ, тогда как dACE2 не был обнаружен в экзосомах, индуцированных бафиломицином или IFNα. Однако dACE2 был обнаружен в небольших количествах в клеточной фракции ЖБАЛ у 50 пациентов. Это не коррелировало с тяжестью COVID-19, хотя dACE2 положительно коррелировал с пропорциями экзосом ACE2+ и MFI ACE2 на экзосомах, полученных из БАЛ.
«Высокие» экзосомные продуценты ACE2+ продемонстрировали активацию генов, участвующих в пути патогенеза CoV, сигнальных путях IFN и фосфоинозитид-3-киназы/протеинкиназы B (PI3K/AKT) и активации цитозольного PRR (рецептора распознавания образов), а также подавление генов, участвующих в сигнальные пути окислительного фосфорилирования и eIF2 (эукариотический фактор инициации 2). Добавление экзосомы ACE2+ к клеточным культурам приводило к дозозависимому снижению N-окрашивания SARS-CoV-2. Результаты микроскопии показали усиленную кластеризацию вирионов и связывание с ACE2, присутствующим на экзосомах.
В результате результатов исследования дефенсосомы потенциально могут быть использованы в качестве агентов против SARS-CoV-2.























Оставить Комментарий
Ваш электронный адрес не будет опубликован. Обязательные поля помечены *