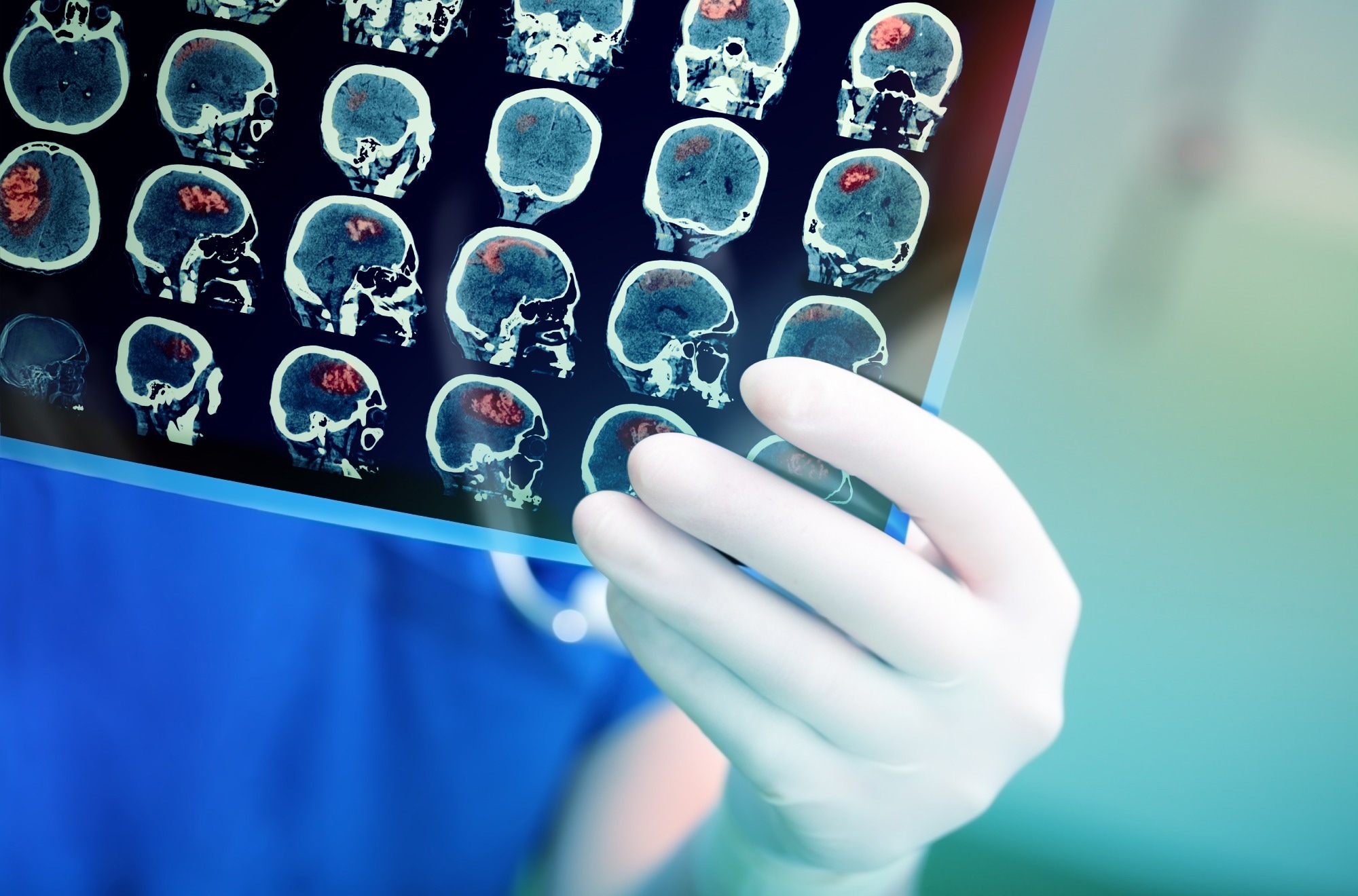
В недавнем исследовании, опубликованном в журнале Brain , исследователи сообщили, что повреждение головного мозга часто встречается при коронавирусной болезни 2019 (COVID-19) и гриппе.
COVID-19 был связан с неврологическими осложнениями, такими как инсульт, аутоиммунный энцефалит и синдром Гийена-Барре. В то время как физическое повреждение головного мозга очевидно при неврологических синдромах, связанных с COVID-19, таких как энцефалит и инсульт, различные отчеты предполагают, что повреждение головного мозга, связанное с COVID-19, может произойти даже в отсутствие сопутствующего неврологического диагноза. Кроме того, преувеличенная воспалительная реакция во время COVID-19 может привести к прогрессированию заболевания в тяжелую форму.
Исследование: повреждение головного мозга при COVID-19 связано с нарушением регуляции врожденного и адаптивного иммунного ответа . Изображение предоставлено: sfam_photo / Shutterstock
Об исследовании
В настоящем исследовании исследователи изучили маркеры хозяина нерегулируемого иммунного ответа. Были включены пациенты с положительным результатом полимеразной цепной реакции (ПЦР) COVID-19, поступившие в больницу Кембриджского университета в период с марта 2020 года по март 2021 года. Кроме того, когорта пациентов была дополнена удобной выборкой пациентов с COVID-19 из университетской больницы Сальгренска, Швеция.
Здоровые субъекты были набраны до пандемии COVID-19 в качестве контроля. Сохраненные клинические данные и данные о плазме пациентов с гриппом из отдельного исследования использовались в качестве дополнительной контрольной когорты. Небольшая группа положительного контроля была включена в качестве эталона для оценки величины повышения биомаркеров повреждения головного мозга. В эту группу вошли больные с острой тяжелой черепно-мозговой травмой.
Образцы сыворотки собирали при поступлении и в период выздоровления в трех точках: острой (< 14 дней), подострой (от 15 до 70 дней) и стадиях выздоровления (> 80 дней; амбулаторно). Пациенты с гриппом/COVID-19 были разделены на три группы тяжести (легкая, средняя и тяжелая) в зависимости от лечения в острой фазе. Легкие пациенты не нуждались в дополнительном кислороде, умеренные пациенты нуждались в дополнительном кислороде, а тяжелые пациенты нуждались в искусственной вентиляции легких.
Глиальный фибриллярный кислый белок (GFAP), свет нейрофиламентов (NfL) и общие концентрации тау измеряли в сыворотке пациентов с COVID-19 или плазме пациентов с гриппом. Аутоантитела подвергали скринингу с использованием индивидуального микрочипа белков центральной нервной системы. Кроме того, сывороточные концентрации фактора некроза опухоли (TNF)-α, интерлейкина (IL)-1β, IL-10, интерферона (IFN)-γ и IL-6 количественно определяли с использованием мультиплексной проточной цитометрии на основе частиц.
Результаты
Исследователи получили 250 образцов от 175 пациентов с COVID-19 и контрольные образцы от 59 здоровых людей и 45 больных гриппом. Семьдесят пациентов с COVID-19 имели легкое течение, 72 — среднее и 33 — тяжелое. Концентрации GFAP, общего тау и NfL превышали функциональный нижний предел количественного определения для большинства образцов здорового контроля и пациентов с COVID-19.
Примечательно, что концентрации GFAP и NfL в сыворотке увеличивались с увеличением тяжести COVID-19 в острые и подострые моменты времени, что соответствует уровням, наблюдаемым у субъектов с тяжелой черепно-мозговой травмой. Различий в общем уровне тау между пациентами и контрольной группой не наблюдалось. Продольные образцы были доступны для 67 пациентов, что позволило изучить временную динамику.

Авторы отметили, что концентрации NfL и GFAP со временем снижались, хотя у некоторых пациентов наблюдалось повышение концентрации NfL между острым и подострым периодами. Концентрации GFAP в сыворотке не отличались между пациентами и контрольной группой в момент выздоровления. Тем не менее, концентрации NfL в сыворотке в момент выздоровления были выше у пациентов с умеренным или тяжелым заболеванием, чем в контрольной группе.
Увеличение общей концентрации тау не зависело от тяжести заболевания. Выздоравливающие уровни GFAP и NfL в сыворотке коррелировали с парными образцами, собранными между 15 и 42 днями, тогда как общие концентрации тау не коррелировали. Более того, концентрации GFAP и NfL в плазме, взятой у больных гриппом с тяжелым течением заболевания, были повышены до уровней, сравнимых с таковыми у пациентов с COVID-19.
Пациенты с COVID-19 демонстрировали явную IgG-реактивность к шиповидным и нуклеокапсидным белкам тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2) и, в частности, к легочному сурфактантному белку А (SFTPA1). Реактивность к SFTPA1 была выше в подострых образцах пациентов со средней и тяжелой степенью тяжести, чем у пациентов с легкой или здоровой группой контроля. Это аутоантитело не было описано в контексте COVID-19.
Кроме того, профили аутоантител когорт сравнивали путем определения количества и мишеней положительных попаданий аутоантител к конкретным антигенам. У пациентов с COVID-19 было больше аутоантител IgG и IgM, чем у здоровых людей. Антимиелин-ассоциированный гликопротеин (анти-MAG) был наиболее распространенным аутоантителом IgG, за которым следовали аутоантитела против SFTPA1, обнаруженные в 9,6% и 8,8% образцов COVID-19 соответственно. Оба аутоантитела не были обнаружены у здоровых людей.
Повышенные уровни цитокинов в сыворотке наблюдались в подострых образцах, и многие образцы выздоравливающих имели повышенные концентрации цитокинов выше нормального диапазона. У пациентов с умеренным и тяжелым течением COVID-19 был повышен уровень провоспалительных цитокинов. Затем команда исследовала связи между биомаркерами повреждения головного мозга и профилями воспаления (цитокиновый и аутоантителевой ответы).
Отмечена положительная корреляция между уровнями NfL и GFAP в сыворотке и количеством попаданий IgG. Тем не менее, общие концентрации тау не были связаны с попаданием IgG или профилями цитокинов. Количество попаданий IgM коррелировало с уровнями NfL в сыворотке, но не с общими концентрациями тау или GFAP. Следует отметить, что исследователи обнаружили корреляцию между количеством попаданий IgM и всеми биомаркерами повреждения головного мозга, особенно общими уровнями тау, в период выздоровления.
Выводы
Настоящее исследование продемонстрировало повышенные концентрации биомаркеров повреждения головного мозга у пациентов с COVID-19, которые увеличивались с тяжестью заболевания во время острой инфекции. Эти повышения коррелировали с наличием аутоантител и провоспалительных цитокинов. Кроме того, были доказательства нарушения регуляции иммунного ответа даже через четыре месяца. Примечательно, что аутоантитела против антигенов головного мозга не предсказывают более сильное повреждение головного мозга, чем антитела против немозговых антигенов.
Это означало, что повреждение головного мозга произошло из-за общего нарушения регуляции иммунитета, а не из-за непосредственно патогенных аутоантител. Кроме того, данные пациентов с гриппом показали, что повреждение головного мозга во время острой инфекции SARS-CoV-2 не является уникальным для COVID-19. В целом, результаты выявили связь биомаркеров повреждения головного мозга с нарушением регуляции иммунитета при COVID-19.



















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.