В недавнем обзоре Viruses представлен обзор того, как геном коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) изменился в ходе пандемии коронавирусной болезни 2019 (COVID-19). С этой целью исследователи проанализировали все общедоступные геномы SARS-CoV-2, 97 437 из которых были выбраны случайным образом для дальнейшего анализа.
Исследование: Взлет и падение вариантов SARS-CoV-2 и продолжающаяся диверсификация Omicron. Изображение предоставлено: CI Photos / Shutterstock.com
Фон
SARS-CoV-2, патоген, ответственный за COVID-19, накопил множество мутаций с тех пор, как он был впервые идентифицирован в декабре 2019 года. Эти мутации привели к появлению более трансмиссивных и устойчивых вариантов SARS-CoV-2, некоторые из которых были классифицированы Всемирная организация здравоохранения (ВОЗ) как варианты, вызывающие озабоченность (ЛОС).
Вариант SARS-CoV-2 Omicron был впервые обнаружен в Южной Африке 9 ноября 2021 г., а 26 ноября 2021 г. ВОЗ объявила его ЛОС. Спайковый белок Omicron состоит из 26–32 мутаций по сравнению с ранее секвенированным вирусом . изолирует.
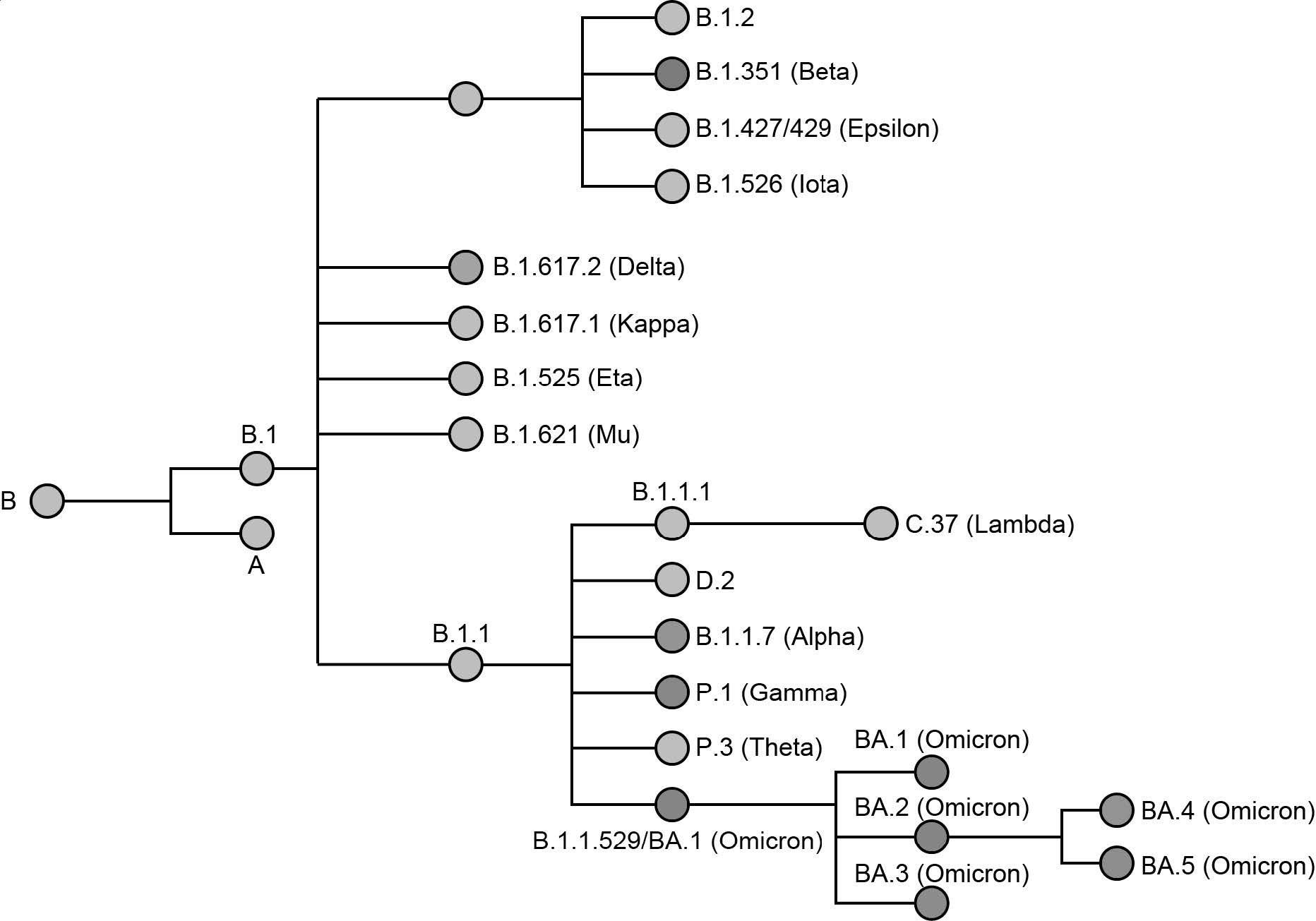
С момента своего первоначального обнаружения Омикрон превратился в пять отдельных подлиний, включая BA.1, BA.2, BA.3, BA.4 и BA.5. Многие из этих подвариантов Омикрона несут ответственность за недавние волны повторных инфекций и прорывных инфекций вакцин.
Вирусные мутации можно разделить на синонимичные и несинонимичные. В то время как синонимичные мутации не влияют на последовательность белка, несинонимичные вызывают изменения в вирусном протеоме. Несмотря на кажущуюся нейтральность синонимичных мутаций, их способность накапливаться с течением времени может приводить к изменению профилей экспрессии белков.
Широко распространенные мутации SARS-CoV-2
97 437 белковых последовательностей SARS-CoV-2, проанализированных в текущем исследовании, выявили несинонимичные мутации в 26 различных последовательностях. Поэтому исследователей особенно интересовала оценка того, влияют ли мутации, приобретенные в связанных с репликацией белках SARS-CoV-2, на процессы репликации вируса. К ним относятся неспецифический белок 7 (Nsp7), Nsp8, Nsp12, Nsp13 и Nsp14, которые были связаны с репликацией варианта Omicron и были проанализированы на наличие приобретенных мутаций.

NutriBiotic, Immunity, аскорбат натрия, кристаллический порошок, 454 г (16 унций)
Мутация P314L в Nsp12, рибонуклеиновой кислоте (РНК)-зависимой РНК-полимеразе, была идентифицирована почти в 98% проанализированных белковых последовательностей SARS-CoV-2. Однако эта мутация не была уникальной среди подлиний Омикрон; таким образом, он не несет ответственности за увеличение числа мутаций в этих новых вариантах вируса.
Другие часто идентифицируемые мутации включали R392C в Nsp13, который представляет собой РНК-хеликазу, а также I42V в Nsp14, который представляет собой 3′-5′ экзорибонуклеазный белок. Однако обе мутации не были расположены рядом с активным сайтом любого белка, что указывает на то, что они аналогичным образом не внесли значительного вклада в эволюцию подвариантов Omicron.
Дальнейший анализ показал, что структурный шип, оболочка, мембрана и нуклеокапсидные белки SARS-CoV-2, а также дополнительные белки, включая открытую рамку считывания 7a (ORF7a), ORF7b, ORF9 и ORF9b, эволюционировали быстрее, чем к неструктурным белкам.
Как развивался Омикрон?
Хотя механизмы возникновения Омикрона остаются неясными, предполагается, что этот вариант развился у пациентов с ослабленным иммунитетом. Эволюция SARS-CoV-2 у этих пациентов может быть связана с их слабой иммунной системой, которая не может уничтожить вирус, но достаточно сильна, чтобы позволить размножаться вариантам с повышенной приспособленностью.
Появление варианта Омикрон могло произойти из-за сильного очищающего отбора по NSP1-16 и сильного диверсифицирующего отбора по структурным и вспомогательным белкам SARS-CoV-2. Другая возможная причина может заключаться в том, что Омикрон представляет собой рекомбинантную версию предкового штамма SARS-CoV-2 и гипермутированный штамм, который еще предстоит идентифицировать.
Тем не менее, необходимы дальнейшие исследования, чтобы выяснить, действительно ли каждый из этих сценариев ответственен за появление варианта Омикрон.
Перспективы будущего
В настоящее время диагностика COVID-19 в основном основывается на обнаружении присутствия нуклеокапсидного белка или гена с помощью анализов антигена и полимеразной цепной реакции (ПЦР) соответственно. Если нуклеокапсидный белок продолжит накапливать мутации, диагноз COVID-19 в будущем может быть поставлен под угрозу.
Мутации в шиповидном белке, который остается основной мишенью современных вакцин и терапевтических средств против COVID-19, также значительно повлияют на индуцированный вакциной и естественный иммунитет. Таким образом, новые вакцины, состоящие из шиповидных белков различных вариантов SARS-CoV-2, могут повысить устойчивость иммунных реакций после иммунизации.
Несмотря на широкое распространение вакцин, число случаев COVID-19 продолжает расти, особенно в связи с выявлением новых подвариантов Omicron. Таким образом, адекватный вирусный надзор посредством диагностики пациентов и отбора проб сточных вод необходим для снижения угрозы новых вариантов SARS-CoV-2.
Авторы заключают: «У этой ситуации нет простого решения, но по мере роста числа случаев заражения и уменьшения количества отслеживаемых мы блуждаем вслепую в неопределенное будущее, и мы подвергаемся большему риску быть застигнутыми врасплох неудачной ролью эволюционных костей. , что может привести к новому варианту с отличными клиническими результатами».



















Оставить Комментарий
Ваш электронный адрес не будет опубликован. Обязательные поля помечены *