В недавнем исследовании, опубликованном на сервере препринтов bioRxiv *, исследователи из Испании, Великобритании и США использовали химические инструменты для раскрытия молекулярных деталей опосредованной гликанами модуляции коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2). ) обработка шипа (S).
Исследование: O-связанные сиалогликаны модулируют протеолиз спайка SARS-CoV-2 и вносят вклад в мутационную траекторию в вызывающих озабоченность вариантах . Кредит изображения: НИАИД
Фон
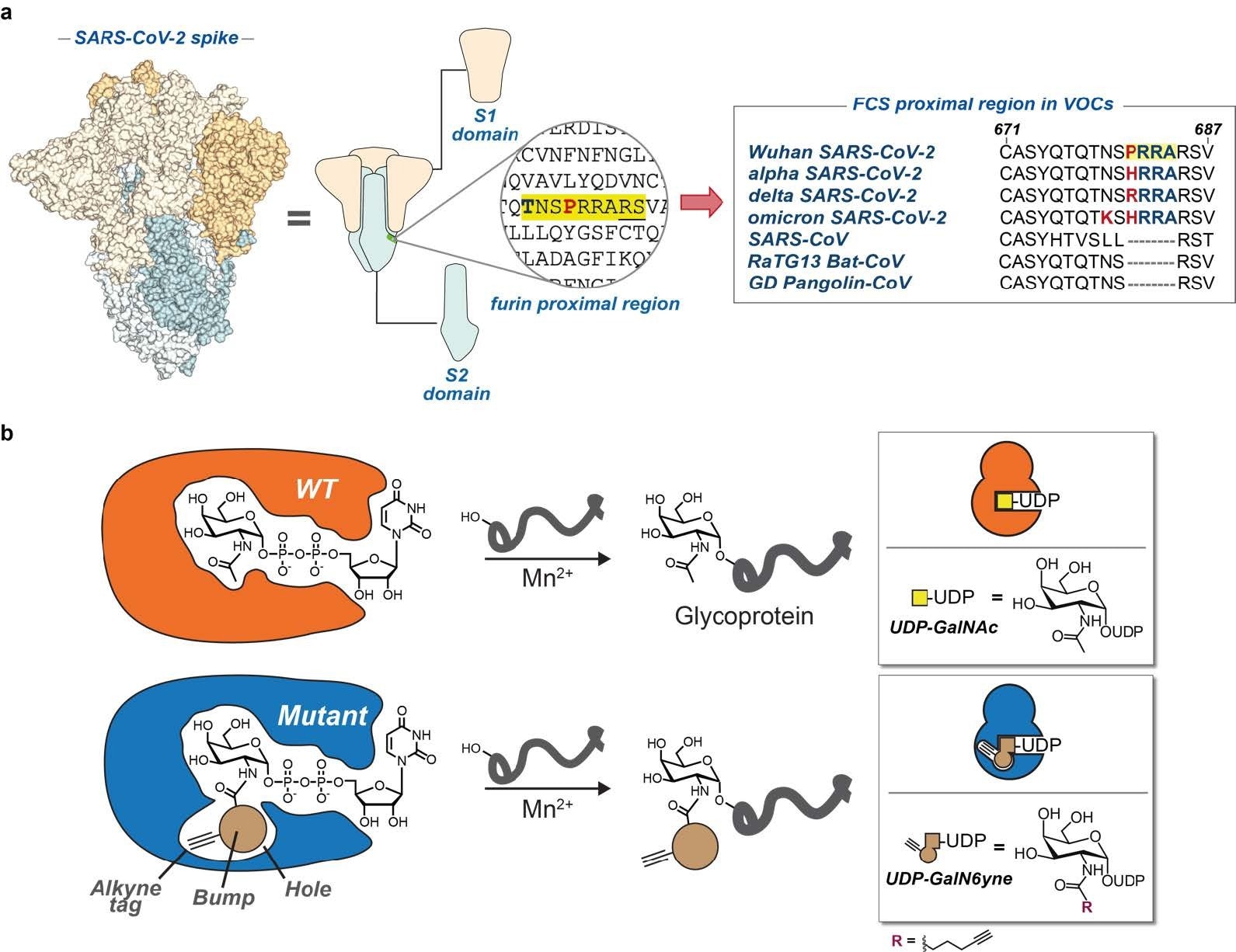
SARS-CoV-2 S представляет собой тримерный многодоменный гликопротеин с плотной гликановой оболочкой. Многоосновный (богатые аргинином пептидные последовательности) сайт расщепления фурином (FCS) в полноразмерном S (FL-S) усиливает связывание с рецепторами клетки-хозяина после расщепления фурином или трансмембранной протеазой серином 2 ( TMPRSS2 ). Усиленное протеолитическое расщепление FL-S на субъединицы S1 и S2 объясняется полиморфизмом между аминокислотными (AA)/пептидными остатками глутамина (Gln)675 и пролина (Pro)681, предшествующего FCS. Примечательно, что эта пептидная область S SARS-CoV-2 также содержит несколько остатков серина (Ser) и треонина (Thr) AA, которые могут нести N-ацетилгалактозаминовые (O-GalNAc) гликаны. По мнению авторов, Ser/Thr-связанное гликозилирование O-GalNAc влияет на фурин- и TRMPSS2-опосредованное расщепление S.
Этот участок АА также наиболее подвержен мутациям; впоследствии, в альфа- и дельта-вариантах SARS-CoV-2 (VOC) имеется несколько мутаций между Pro681 и гистидином (His) и аргинином (Arg) соответственно. Во всех подлиниях Omicron, включая BA.1, BA.2 и BA.5, есть мутации в P681H и N679K. Все эти мутации усиливают S-протеолитическое расщепление. Изучение этого участка пептида в S SARS-CoV-2 представляет собой аналитическую задачу из-за сложности его биосинтеза и отсутствия консенсусной последовательности пептида. Более того, отсутствуют данные о распространенности гликанов, их сайтах прикрепления и их структурном влиянии на протеолиз. Кроме того, в исследованиях почти не изучалась роль мутаций ЛОС SARS-CoV-2 в гликозилировании O-GalNAc.
Существует семейство из 20 изоферментов GalNAc-трансферазы, от GalNAc-T1 до T20 с различными субстратами. Идентификация сайтов гликозилирования каждого GalNAc-T может дать представление о биологии O-гликанов. В предыдущем исследовании, проведенном Ten Hagen et al., они обнаружили семь изоферментов, которые могут ввести GalNAc в вирус SARS-CoV-2.
Об исследовании
В настоящем исследовании исследователи использовали тактику химической инженерии, называемую «инженерия с выпуклостью и дырой (BH)», для изучения отдельных изоферментов GalNAc-T в живой клетке. Кроме того, они настаивали на том, что улучшение секвенирования гликопептидов на основе фрагментации может обеспечить расширенный анализ на основе масс-спектрометрии (МС).
Сначала исследователи инкубировали рекомбинантный S штамма дикого типа (WT) SARS-CoV-2 с конструкциями P681R (или P681H), полученными в клетках Expi293-F человека, с WT- или BH-версиями GalNAc-T1 или T2. Затем они продолжили смешивать эти конструкции с нуклеотид-сахар-уридин-дифосфатом (UDP)-GalN6yne. Они пометили гликозилированные версии с помощью катализируемого медью (I) азид-алкинового циклоприсоединения (CuAAC) для визуализации с помощью стрептавидинового блота. Эта обработка вводила GalN6yne изофермент-специфическим образом, в то же время наделяя гликопептиды дополнительным положительным зарядом, что облегчало MS-анализ.
Profoot, Goodnight Bunion, регулятор Bunion, 1 пара
а) Модель шипа SARS-CoV-2 и мультфильм. Сайт расщепления фурином и выравнивание пептидов для вызывающих озабоченность вариантов COVID-19 и родственных коронавирусов . Желтым цветом выделен полиосновный мотив SARS-CoV-2. Жирным шрифтом и красным цветом выделены аминокислотные замены в положениях 679 и 681. субстрат UDPGalN6yne. FCS = сайт расщепления фурином; ЛОС = варианты, вызывающие озабоченность.
Затем команда подвергла субъединицы FL-S и S1/S2 перевариванию в геле и проанализировала их с помощью тандемной МС (ETD). Они использовали высокоинтенсивную индуцированную столкновением диссоциацию (HCD) для получения обнаженных пептидных последовательностей и композиций гликанов, а затем использовали диагностический ион I-tagged-GalN6yne для запуска ETD-фрагментации пептидного остова. Исследователи также подтвердили результаты исследования in vitro . С этой целью они использовали гликозилирование рекомбинантно экспрессируемых S-белков с растворимыми версиями BH-GalNAc-T1 и BH-GalNAc-T2 и CuAAC с I-меченым азидом и гликопротеомный анализ MS.
Команда использовала панель синтетических пептидов для изучения влияния мутаций белка S на гликозилирование, опосредованное GalNAc-T1. Эти пептиды имели связанные с SARS-CoV-2 ЛОС мутации в основных горячих точках: Gln675, Gln677, аспарагин (Asn)679 и Pro681.
Гликозилирование модулирует протеолитический процессинг S в зависимости от расстояния до сайта расщепления и состава гликанов. Итак, команда напрямую исследовала, модулируют ли гликаны O-GalNAc на Thr678 расщепление S фурином, используя синтетические пептиды активного субстрата Förster Resonance Energy Transfer (FRET). Пептиды, охватывающие остатки Gln с 672 по 689, содержат N-концевой 2-аминобензоил и С-концевой 3-нитро-Tyr в качестве донора флуоресценции и гасителя флуоресценции соответственно. Увеличение интенсивности флуоресценции указывало на фурин-опосредованное расщепление S. Во-первых, они сравнили негликозилированные субстраты, соответствующие WT (FRET-1) и мутантному шипу P681H (FRET-2). Кроме того, они подвергли рекомбинантный TMPRSS2 воздействию гликопептидных субстратов FRET FRET-1, FRET-3 и FRET-7 до FRET-9.
Результаты исследования
Вычислительная и ручная проверка показала, что Thr678 несет I-меченый модифицированный GalN6yne как в образцах FL-S, так и в образцах S1 только в клетках, экспрессирующих BH-T1. И BH-T1, и BH-T2 гликозилированный треонин (Thr)323 не были связаны с каким-либо изоферментом GalNAc-T. Анализ FRET показал, что выработка гликанов O-GalNAc на Thr678 S-гликопротеина SARS-CoV-2, особенно с отрицательно заряженными модификациями, серьезно препятствует активности фурина. Наличие O-гликанов в эпителиальных клетках легких, экспрессирующих GalNAc-T1, свидетельствует о том, что гликозилирование является физиологически значимой модификацией, ограничивающей созревание S-белка в ходе эволюции.
По мнению авторов, нарушение гликозилирования O-GalNAc было основной движущей силой эволюции летучих органических соединений SARS-CoV-2. В рамках эволюционной траектории от SARS-CoV-2 Alpha до ЛОС Delta и Omicron заметные изменения в последовательностях AA, предшествующих FCS, указывали на то, что протеолитическое расщепление постепенно усиливалось с увеличением инфекционной способности ЛОС. Аналогичная мутация, обнаруженная в более трансмиссивном Delta VOC (P681R), также была связана с увеличением расщепления фурина, что указывает на эволюционную траекторию, которая подавляет O-гликозилирование до увеличения внутреннего распознавания фурина.
В отличие от P681H, обнаруженного в ранних вариантах, таких как Alpha, мутация N679K в Omicron существенно не влияла на гликозилирование, но приводила к усиленному расщеплению синтетических пептидов фурином. Эти FCS-проксимальные мутации действовали синергически и эволюционировали, подавляя гликозилирование и усиливая расщепление фурина.
Выводы
Настоящее исследование установило, что O-гликозилирование является ключевым фактором, определяющим расщепление и созревание S SARS-CoV-2. Это также может быть остатком предковых штаммов SARS-CoV-2, утраченных в результате вирусной эволюции.
Исследователи доказали, что GalNAc-T1 инициирует гликозилирование Thr678 в живых клетках. Сайт гликозилирования Thr678 S (не близко к FCS) объясняет, почему одного остатка GalNAc недостаточно для модуляции активности фурина и лишь незначительно влияет на активность TMPRSS2. Напротив, обработка и сиалирование снижали активность фурина до 65%. Точно так же O-гликозилирование отрицательно влияло на расщепление S с помощью TMPRSS2, при этом наибольший эффект оказывали O-гликаны, содержащие ядро 1 (Galβ1-3GalNAc-). В целом результаты исследования подчеркивают необходимость более совершенных методов отслеживания гликанов для изучения эволюции SARS-CoV-2.
*Важное замечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются экспертами и, следовательно, не должны рассматриваться как окончательные, направляющие клиническую практику/поведение, связанное со здоровьем, или рассматриваться как установленная информация.



















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.