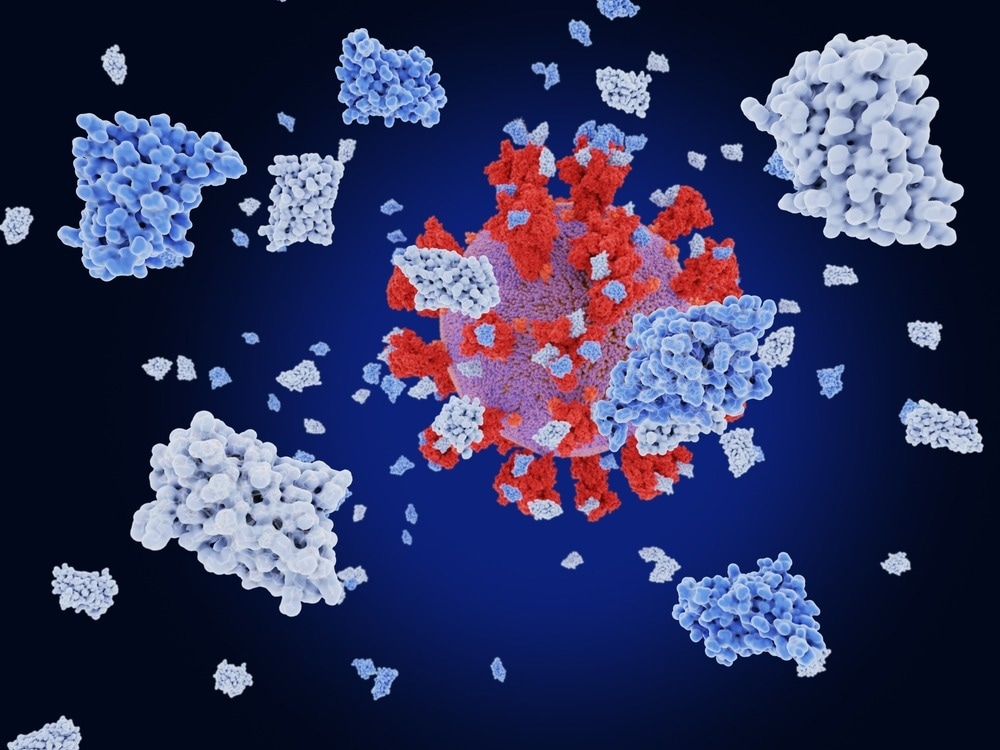
В недавнем исследовании, опубликованном на сервере препринтов bioRxiv * , исследователи исследовали инженерию нанотел для разработки противовирусных и диагностических средств против коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2).
Фон
Всемирные усилия по сдерживанию недавней пандемии коронавирусной болезни 2019 года (COVID-19) привели к разработке многих терапевтических и диагностических технологий на основе антител, начиная от экспресс-тестов на антигены и заканчивая моноклональными антителами для лечения тяжелых симптомов COVID-19 .
Многие моноклональные антитела и вакцины против COVID-19 нацелены на спайковый белок SARS-CoV-2 из-за его роли в связывании с мембраной клетки-хозяина и проникновении вируса. Недавние исследования показали, что мутации в рецептор-связывающем домене (RBD) субъединицы S1 шиповидного белка приводят к появлению новых вариантов, которые бросают вызов эффективности существующих моноклональных антител и вакцин против COVID-19.
Текущие исследования против уклонения от иммунитета, проявляемого некоторыми из новых вариантов SARS-CoV-2, сосредоточены на разработке новых технологий на основе антител, таких как фрагменты однодоменных антител верблюдовых или нанотела. Хотя было охарактеризовано несколько нанотел, нейтрализующих SARS-CoV-2, использование нанотел в диагностических инструментах остается в значительной степени неизученным.
Об исследовании
В настоящем исследовании исследователи создали многомодульные нанотела путем слияния доменов нанотел, которые связываются с разными сайтами связывания. Эти домены были слиты с использованием гибких линкеров из 20 аминокислот и могли одновременно связываться с разными эпитопами, увеличивая силу связывания и потенциально снижая ускользание от иммунного ответа возникающими вариантами.
Комбинации четырех ранее разработанных мономерных нанотел были использованы для создания трех тримодульных нанотел — tri-Ty1, tri-TMH и tri-TMV. Анализы нейтрализации были проведены in vitro для проверки нейтрализующей способности многомодульных нанотел против SARS-CoV-2 дикого типа и его вариантов Alpha, Beta, Delta и Omicron. Антигенный микрочип был использован, чтобы понять, как аминокислотные изменения в RBD влияют на связывание трех тримодульных нанотел.

Solgar, пиколинат цинка, 100 таблеток
Кроме того, модульные свойства нанотел были использованы для разработки диагностического анализа, состоящего из RBD-связывающих нанотел, слитых с расщепленными фрагментами сконструированного флуоресцентного белка люциферазы NanoLuc, который действует как сигнальная молекула. Диагностический анализ основан на том принципе, что когда расщепленные фрагменты NanoLuc сближаются за счет связывания нанотел с тримерами шипа SARS-CoV-2, слияние фрагментов приводит к флуоресцентному сигналу. Исследователи считают, что это поможет обнаружить субнаномолярные уровни шиповидных белков SARS-CoV-2 за один шаг.
Полученные результаты
Результаты сообщают о 100-кратном увеличении эффективности нейтрализации многомодульных нанотел, разработанных в этом исследовании, по сравнению с полумаксимальной ингибирующей концентрацией (IC50) отдельных составляющих нанотел.
Конструкция нанотела с три-ТМГ была самым сильным нейтрализатором SARS-CoV-2 дикого типа и альфа-варианта, но проявляла сниженную эффективность в отношении дельта-варианта. Все три мультимодульных нанотела оказались неэффективны в нейтрализации вариантов Бета и Омикрон. Профилактические дозы три-ТМГ, вводимые в полость носа животных моделей, ограничивали повреждение легочной ткани.
По мнению авторов, мутация E484K, присутствующая в вариантах Beta и Omicron, но отсутствующая в SARS-CoV-2 дикого типа и других вариантах, ответственна за снижение эффективности трех конструкций нанотел. Эта мутация приводит к изменениям в аминокислотах, которые разрушают солевые мостики и вызывают конформационные изменения в RBD, тем самым влияя на интерфейс связывания нанотел.
Диагностический анализ на основе нанотел, разработанный в этом исследовании, успешно обнаружил спайковый белок SARS-CoV-2 в концентрациях до 200 пМ. Эти уровни обнаружения были сопоставимы с другими методами тестирования на антиген, такими как анализ на основе переноса энергии резонанса флуоресценции (FRET), и результаты были аналогичны коммерчески доступным тестам на антиген.
Выводы
В целом, исследование представляет многообещающую противовирусную и диагностическую альтернативу моноклональным антителам с разработкой многомодульных нанотел с повышенной авидностью связывания и способностью связываться с несколькими эпитопами одновременно.
Проверочные эксперименты показывают, что новый диагностический инструмент на основе нанотел может обнаруживать очень низкие концентрации спайкового белка SARS-CoV-2. Анализ требует дальнейшей проверки с образцами пациентов для коммерческого использования в качестве диагностического инструмента. Однако сравнительно низкие производственные затраты и отсутствие ресурсоемких требований, таких как культуры тканей животных, делают нанотела привлекательной альтернативой в противовирусных исследованиях и тестировании.
С быстро появляющимися вариантами SARS-CoV-2, бросающими вызов эффективности моноклональных антител и вакцин, относительно недорогие и модифицируемые нанотела представляют собой реальный вариант для противовирусной терапии и диагностических тестов.
*Важное замечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются и, следовательно, не должны рассматриваться как окончательные, направляющие клиническую практику/поведение, связанное со здоровьем, или рассматриваться как установленная информация.



















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.