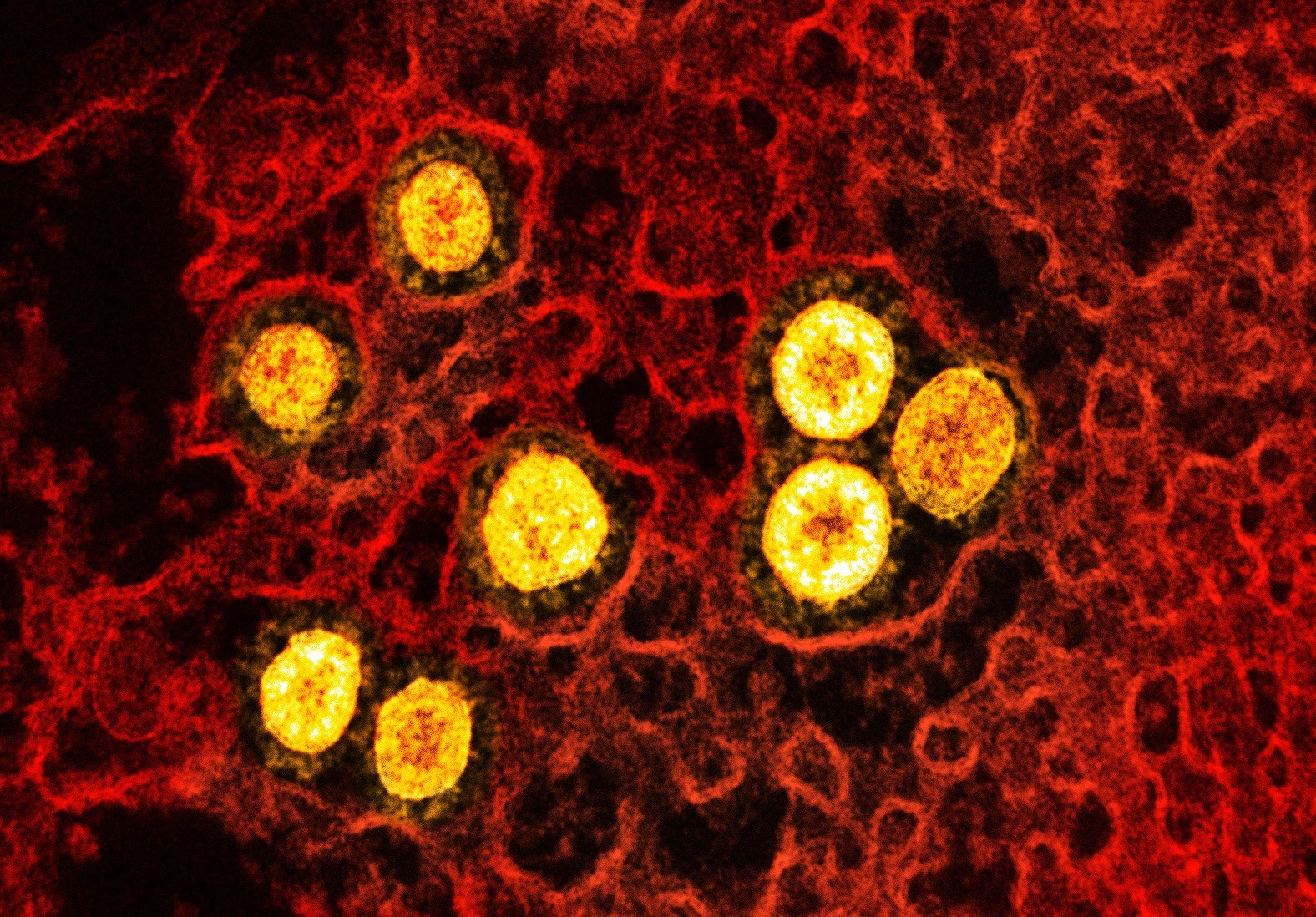
В недавнем исследовании, опубликованном на сервере bioRxiv *, исследователи из США продемонстрировали эффективность нового биополимера, N-дигидрогалактохитозана (ГХ), в качестве адъюванта для вакцины нового поколения против коронавирусной болезни слизистых оболочек 2019 (COVID-19).
Исследование: новый биополимер для адъюванта слизистой против респираторных патогенов . Изображение предоставлено: NIAID
Фон
Клиренс респираторных вирусных инфекций требует, чтобы вакцина индуцировала широкий набор антител. Сюда входят гуморальные компоненты иммунитета, такие как иммуноглобулины (Ig)A и IgG, Т-хелперы 1 (Th1) и гамма-интерферон (IFNγ); кроме того, у них есть ветвь клеточного иммунитета, состоящая из цитотоксических Т-клеток. Обычно респираторные вирусы поражают верхние дыхательные пути (ВДП); однако они также могут причинить больший ущерб, приводящий к пневмонии, повреждению легких или даже смерти, в первую очередь у маленьких детей и пожилых людей.
Поскольку мукозальные вакцины вызывают местный и системный гуморальный и клеточный иммунитет, они кажутся привлекательным вариантом против всех респираторных вирусов, включая коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2). Современные интраназальные вакцины используют живые аттенуированные вирусы (LAV) или белковые субъединицы. Однако в процессе аттенуации иммуногенность возбудителя может быть нарушена, что приводит к умеренной иммунной защите. Следовательно, все вакцины на основе LAV или белковых субъединиц требуют адъювантов для повышения их иммуногенности.
Другими важными функциями адъюванта являются способность противостоять суровым условиям поверхности слизистой оболочки, сохранять антиген в месте инокуляции в течение длительного времени, активировать и привлекать иммунные клетки к месту введения вакцины и стимулировать иммунный ответ, напоминающий патогенный. . В отношении респираторных вирусных патогенов идеальный адъювант также должен вызывать ответ IFN I типа.
Хотя циклические динуклеотиды вызывают выработку IFN I типа через стимулятор передачи сигналов гена интерферона (STING), их необходимо вводить в больших количествах и многократно для усиления гуморального и клеточного иммунитета. GC, синтезированный из галактозы и хитозана, весьма эффективно индуцирует путь IFN I типа. Кроме того, он обладает благоприятными биофизическими свойствами для использования в качестве адъюванта вакцины. Например, ГК более растворим, чем хитозан, обладает мукоадгезивной природой, низкой токсичностью и рН-стойкостью, биосовместим. GC используется в качестве коммерческого лекарственного препарата (IP-001) для создания системного противоопухолевого иммунного ответа при введении с аблацией опухоли.
Об исследовании
Поскольку эффективный адъювант вакцины сохраняет антигены , в настоящем исследовании исследователи сначала изучили способность GC удерживать овальбумин, помеченный техасским красным (OVA-TR). Они использовали различные концентрации GC, 0,5, 0,75, 0,9 или 1%, с OVA-TR для вакцинации мышей C57BL/6. Затем они продолжали флуоресцентную визуализацию всего тела в течение семи дней. Кроме того, исследователи провели объемный анализ секвенирования рибонуклеиновой кислоты (РНК) стимулированных GC дендритных клеток костного мозга (BMDC).

Kyolic, Aged Garlic Extract, выдержанный экстракт чеснока с лецитином, 200 капсул
Кроме того, команда использовала ГК, иммуностимулятор или адъювант, с рекомбинантными белками тримерных шипов (S) и нуклеокапсида (NC) SARS-CoV-2. Они использовали этот состав вакцины для интраназальной (IN) вакцинации трансгенных мышей K18-человеческого ангиотензинпревращающего фермента 2 (hACE2) по сравнению с Addavax (AV). Две недели спустя они собрали сыворотку, легкие и шейные лимфатические узлы (cLN) всех подопытных животных для анализа. Наконец, команда изучила количество Т- и В-клеток, находящихся в cLN, и клеточность легких после введения двух доз вакцины.
Результаты исследования
GC сохранял антигены в месте введения в соответствующей концентрации. Соответственно, авторы наблюдали, что почти 50% OVA-TR оставалось в месте введения 1% раствора GC через три дня после инъекции. Кроме того, GC индуцировал антиген-специфический гуморальный иммунный ответ, превосходящий AV, при доставке через слизистую оболочку.
Кроме того, GC активировал несколько различных рецепторов распознавания образов нуклеиновых кислот (PRR), все из которых были ниже по течению от передачи сигналов STING и приводили к продукции IFN I типа и IL-1β. Он также активировал иммунные пути, участвующие в реакции на COVID-19. ГК не вызывал неспецифической активации Т-клеток, но активировал антигенпрезентирующие клетки (АПК). IFN типа I усиливают эффекторную функцию и клональную экспансию при презентации антигена, тогда как IL-1β усиливает дифференцировку, формирование памяти и миграцию антиген-примированных CD4+ и CD8+ Т-клеток, что, в свою очередь, повышает эффективность слабоиммуногенных вакцин.
Вакцинация GC+S рекрутировала больше Т-клеток в подмышечные лимфатические узлы, чем вакцинация AV+S. Кроме того, вакцинация GC значительно увеличивала клеточность CD4+ T-клеток в cLN, хотя один только S-белок не мог этого сделать.
Белок NC обладает высокой иммуногенностью, имеет гораздо более низкую скорость мутаций, чем белок S, и обеспечивает устойчивый ответ Т- и В-клеток. Соответственно, вакцинация GC+S+NC генерировала S-специфические ответы антител в легких и сыворотке после двухдозового режима. Что еще более важно, GC+S+NC увеличивали клеточность Т-клеток в cLN и приводили к тенденции увеличения Т- и В-клеток в легких после двухдозового режима вакцинации.
Через шесть недель после второй вакцинации исследователи заразили трансгенных мышей K18-hACE2 интраназально SARS-CoV-2. Патология легких показала, что животные, вакцинированные AV+S+NC, страдали тяжелыми бронхоэктазами и интерстициальным воспалением через три и шесть дней после заражения. Это открытие показало, что при инфекциях нижних дыхательных путей следует использовать только подходящий адъювант, поскольку неправильный тип может усугубить патологию легких.
Интересно, что мыши, вакцинированные GC+S+NC, защищали легкие животных от повреждения бронхиол, вызванного заражением SARS-CoV-2. Мыши, вакцинированные GC+S+NC, практически не испытывали респираторного дистресса, что приводило к значительному снижению заболеваемости и смертности, даже несмотря на то, что их кумулятивные оценки гистопатологии не были низкими.
Вывод
Текущее исследование показало, что GC может служить мощным адъювантом слизистой оболочки против тяжелой патологии легких и смертности у мышей благодаря своим биофизическим свойствам. Будущие исследования должны понять локализованный иммунный эффект ГК на слизистую оболочку носа, продолжительность иммунного ответа, вызванного ГК, и изменение параметров вакцины для развития наиболее эффективного интраназального иммунного ответа.
*Важное замечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются экспертами и, следовательно, не должны рассматриваться как окончательные, направляющие клиническую практику/поведение, связанное со здоровьем, или рассматриваться как установленная информация.


















Оставить Комментарий
Ваш электронный адрес не будет опубликован. Обязательные поля помечены *