В недавнем исследовании, опубликованном на сервере bioRxiv *, исследователи изучили роль открытой рамки считывания 3c (ORF3c), вспомогательного белка коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2), который еще не так широко изучен. Они определили клеточную локализацию ORF3c, его роль в модулировании противовирусного ответа хозяина (например, аутофагии) и его влияние на митохондриальный метаболизм.
Фон
Поскольку варианты SARS-CoV-2 продолжают появляться, существует необходимость в более глубоком понимании его патогенных механизмов для обоснования стратегий смягчения последствий и лечения. Исследования расшифровали две последовательные фазы коронавирусной болезни 2019 года (COVID-19) с различными метаболическими особенностями. Первая фаза представляет собой гипервоспалительную фазу, характеризующуюся эффектом Варбурга, когда увеличивается аэробный гликолиз, выработка аденозинтрифосфата (АТФ)/энергии и потребление кислорода.
Хозяин активирует врожденный иммунитет и увеличивает выработку энергии, скорее всего, для борьбы с атакой SARS-CoV-2. Эта фаза часто завершается цитокиновым штормом . Затем следует вторая гиповоспалительная, иммунотолерантная фаза, в которой потребление кислорода падает, а митохондриальное дыхание и производство АТФ возвращаются к нормальному уровню, а также происходит окисление жирных кислот.
SARS-CoV-2 имеет геном одноцепочечной рибонуклеиновой кислоты (РНК) размером 30 килобаз. Его геномная РНК с положительной цепью транслирует две перекрывающиеся ORF, ORF1a и ORF1b, которые, в свою очередь, генерируют 16 неструктурных белков (NSP). Геномные исследования также выявили несколько неаннотированных альтернативных открытых рамок считывания внутри ORF3a, таких как ORF3b, ORF3c и ORF3d. Анализ интерактома вируса-хозяина предполагает, что эти белки физически связываются с белками SARS-CoV-2 и играют решающую роль в жизненном цикле вируса, инфекции, репликации и почковании. Среди них взаимодействия с человеческими митохондриальными белками кажутся особенно многочисленными.
Несколько исследователей предположили, что изменения митохондриальной динамики, включая митохондриальное деление и слияние, являются отличительной чертой патологии COVID-19. Например, Ганс и др. показали, что белок ORF9b локализуется в митохондриях и противостоит интерферонам I и III типов (IFN), воздействуя на множественные врожденные противовирусные сигнальные пути. Дополнительные белки с митохондриальной локализацией очень важны для идентификации терапевтических мишеней COVID-19 и понимания механизмов заболевания, вызванного SARS-CoV-2. Тем не менее, белок ORF3c остается не охарактеризованным и недостаточно изученным, возможно, потому, что этот белок кодируется только сарбековирусами. Тем не менее, данные профилирования рибосом убедительно свидетельствуют о том, что ORF3c является функциональным белком.
Об исследовании
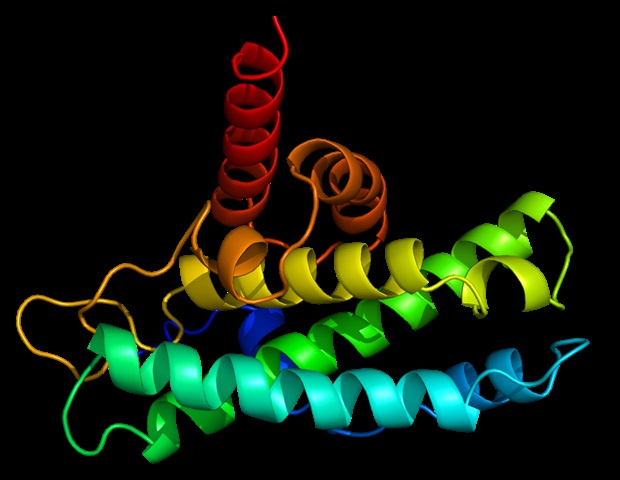
В настоящем исследовании исследователи изучили влияние ORF3c SARS-CoV-2 на врожденные иммунные реакции, аутофагию и митохондриальный метаболизм клеток легких. ORF3c SARS-CoV-2 на 90 % совпадает с SARS-CoV и на 95 % с bat-CoV RaTG13. Поскольку полная структура белка недоступна, исследователи смоделировали белки SARS-CoV-2 и ORF3c летучих мышей, чтобы предсказать их структуру с помощью программного обеспечения RoseTTAFold, в котором используется алгоритм глубокого обучения.
Кроме того, исследователи исследовали митохондриальную локализацию ORF3c с помощью конфокальной микроскопии, для чего они трансфицировали клетки HeLa вектором pDsRed2-Mito. Они также подтвердили митохондриальную локализацию ORF3c, используя две линии клеток легких A549 и HSAEC1. Кроме того, команда исследовала, как белок ORF3c модифицировал митохондриальный метаболизм, с помощью анализа митостресс Agilent Seahorse XF. Впоследствии они исследовали зависимость митохондрий от различных субстратов, а именно от глюкозы (пирувата), глутамина (глутамата) и жирных кислот с длинной цепью, используя набор для тестирования Seahorse Mito Fuel Flex.
Наконец, команда исследовала эффекты 26 цитокинов и хемокинов в клетках, трансфицированных векторами, экспрессирующими ORF3c. SARS-CoV-2 эволюционировал, чтобы изменить функции митохондрий, чтобы ослабить противовирусную защиту хозяина. Точно так же он препятствует образованию или созреванию аутофагосом в клетках-хозяевах, механизму, с помощью которого клетки-хозяева избавляются от патогенов.
Результаты исследования
Структурное предсказание выявило трехмерную архитектуру ORF3c с двумя короткими альфа-спиралями (α1 и α2), соединенными петлевой областью. Спираль α2 соответствовала предсказанной трансмембранной области. Белки SARS-CoV-2 и ORF3c летучих мышей различались аминокислотами R36K и K40R, что позволяет предположить, что эти два белка не претерпели многих конформационных изменений. Иммунофлуоресцентный анализ показал, что белок ORF3c совместно локализован с транслоказой внешней мембраны 70 (TOM70) и TOM20, двумя белками внешней митохондриальной мембраны. Фракционный анализ в клетках HeLa дополнительно подтвердил, что растворимая и нерастворимая (мембранные) фракции ORF3c были почти исключительно локализованы в митохондриях.
Скорость потребления кислорода в реальном времени (OCR) показала, что белок ORF3c увеличивает базальное и максимальное дыхание и митохондриальный синтез АТФ. Однако профили скорости внеклеточного подкисления (ECAR) не показали увеличения гликолиза. Сверхэкспрессия каждой ORF приводила к увеличению скорости оттока протонов (PER) из митохондрий и снижению гликолитического PER.
По сравнению с контрольными клетками митохондрии трансфицированных клеток не могли обойти ингибиторы пути жирных кислот за счет использования двух других видов топлива. Им также требовались жирные кислоты для поддержания базального уровня потребления кислорода (OCR). Обнадеживает то, что клетки, трансфицированные ORF3c, хотя и проявляют некоторые легкие признаки окислительного стресса, были способны амортизировать негативные эффекты накопленного перекиси водорода благодаря присутствию достаточного количества поглотителей активных форм кислорода (АФК).
Хотя ORF3c не могла модифицировать экспрессию 62 генов, участвующих в врожденном и адаптивном иммунитете, ORF3c SARS-CoV-2 индуцировала повышение уровней LC3-II и p62 по сравнению с контролем, что указывает на увеличение количества аутофагосом, в то время как ORF3c летучих мышей не вызывала этого. влияет на уровень аутофагосомных маркеров.
Выводы
Данные исследования показали, что ORF3c является важным вспомогательным белком, который играет решающую роль в патогенезе SARS-CoV-2 и прогрессировании COVID-19. Исследователи заметили, что ORF3c имеет митохондриальную локализацию, изменяет митохондриальный метаболизм и увеличивает продукцию АФК. Он также предотвращал аутофагическую деградацию, изменяя рН лизосом. Однако ORF3c не модулирует экспрессию интерферонов и цитокинов/хемокинов. Тем не менее, остается неясным, как ORF3c изменяет метаболическое состояние клеток, инфицированных SARS-CoV-2. Таким образом, будущие исследования должны изучить подробный механизм, с помощью которого вспомогательные белки SARS-CoV-2 изменяют митохондриальный метаболизм и блокируют поток аутофагии.
*Важное замечание
bioRxiv публикует предварительные научные отчеты, которые не рецензируются экспертами и, следовательно, не должны рассматриваться как окончательные, направляющие клиническую практику/поведение, связанное со здоровьем, или рассматриваться как установленная информация.






















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.