В качестве целевых групп адаптивной иммунной системы Т-лимфоциты отвечают за атаку и уничтожение инфицированных или раковых клеток. Такие клетки, как и почти все клетки человеческого организма, имеют на своей поверхности фрагменты всех белков, которые они производят внутри. Если они включают пептиды, которые Т-лимфоцит распознает как чужеродные, лимфоцит активируется и убивает рассматриваемую клетку. Поэтому для надежного ответа Т-клеток важно, чтобы Т-лимфоцитам были представлены подходящие белковые фрагменты. Исследовательская группа под руководством Саймона Тровича и Роберта Тампе из Института биохимии Университета Гёте во Франкфурте пролила свет на то, как клетка выбирает эти белковые фрагменты или пептиды.
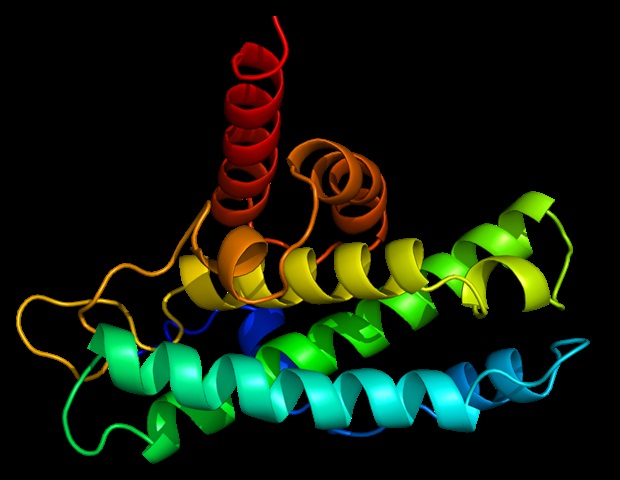
Презентация пептида происходит на молекулах так называемого главного комплекса гистосовместимости класса I (MHC I). Молекулы MHC I представляют собой группу очень разнообразных поверхностных белков, которые могут связывать множество различных пептидов. Они закрепляются в клеточной мембране и своей обращенной наружу частью образуют карман для связывания пептидов. Как и все поверхностные белки, молекулы MHC I проходят так называемый секреторный путь: они синтезируются в полостной системе клетки (эндоплазматический ретикулум (ЭР) и аппарат Гольджи) и там сворачиваются. Затем мелкие везикулы отпочковываются от системы полостей, мигрируют к клеточной мембране и сливаются с ней.
Процесс созревания молекул MHC I очень строго контролируется: в ЭПР белки, известные как «шапероны», помогают им складываться. Шаперон тапазин необходим для загрузки пептидов в этом процессе. «Когда молекула MHC I связывается с пептидом, тапазин проверяет, насколько плотно это связывание», — говорит Трович, объясняя задачу шаперона. «Если связь нестабильна, пептид удаляется и заменяется прочно связывающимся». Однако пока не удалось уточнить, как именно тапазин выполняет эту задачу — тем более, что процесс загрузки чрезвычайно быстрый.
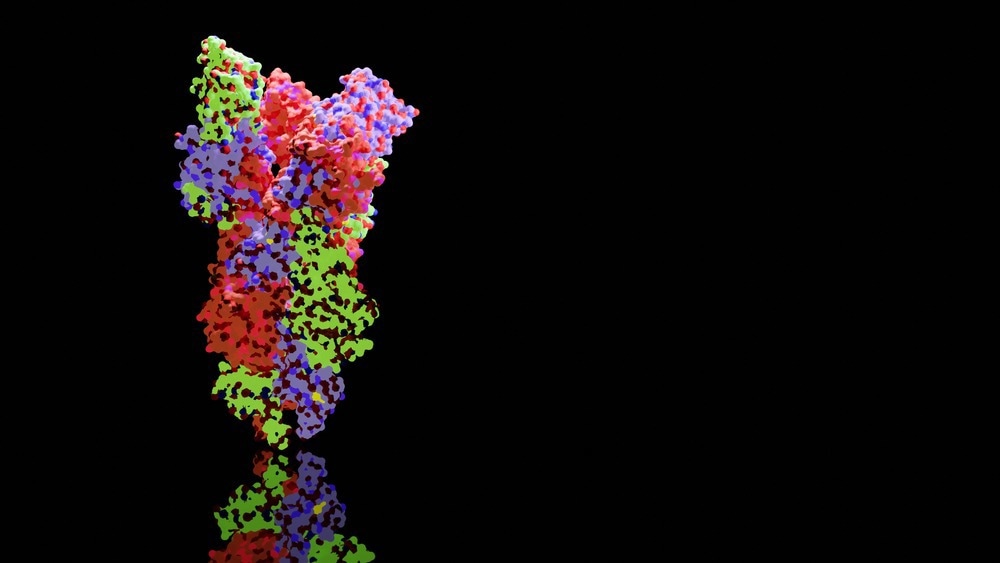
Биохимикам и структурным биологам из Университета Гёте во Франкфурте впервые удалось визуализировать кратковременное взаимодействие между шапероном и молекулой MHC I с помощью рентгеноструктурного анализа. Для этого они произвели варианты двух партнеров по взаимодействию, которые больше не были встроены в мембрану, очистили их и объединили. Уловка помогла зафиксировать загрузочный комплекс в действии для кристаллизации: сначала исследовательская группа загрузила молекулу MHC I высокоаффинным пептидом, чтобы был создан стабильный комплекс. Световой сигнал запускал расщепление пептида, что сильно снижало его способность связывать молекулу MHC I. Сразу же на сцену вышел тапазин, который остался связанным с молекулой MHC I, в которой отсутствует его пептид. «
Рентгеноструктурный анализ кристаллов показал, как тапазин расширяет пептидсвязывающий карман молекулы MHC I, тем самым проверяя прочность пептидной связи. Для этого партнеры по взаимодействию образуют большую зону контакта; для стабилизации петля тапасина находится поверх расширенного кармана для крепления. «Это первый раз, когда мы показали процесс загрузки в высоком разрешении», — с удовлетворением сообщает Тампе. Изображения также показывают, как один шаперон может взаимодействовать с огромным разнообразием молекул MHC I, говорит биохимик: «Тапазин точно связывает неизменяемые области молекул MHC I». Однако новая структура не только улучшает наше понимание сложных процессов, связанных с загрузкой молекул MHC I. Это также должно помочь в выборе подходящих кандидатов для разработки вакцины.
















Оставить Комментарий
Вы должны войти, чтобы оставить комментарий.